我们可以为您提供的自主服务项目主要有:
出口欧洲法规:欧盟CE认证(CE整套技术文件编订、 CE四版临床评价(MEDDEV 2.7.1 Rev 4)编写)、ISO13485:2016认证、欧盟授权代表(德国,英国和荷兰)、欧盟注册、欧盟自由销售证书、防护服PPE指令Type5/6认证
出口美国法规:医疗器械、化妆品、食品美国FDA注册(含FDA510K申请)、美国代理人、 FDA 验厂辅导及整改、FDA警告信应对&RED LIST REMOVAL、QSR820体系辅导、食品FDA验厂辅导及整改、OTC药品FDA验厂辅导及整改
中国法规:医疗器械产品备案登记表、医疗器械产品注册证、生产备案登记表、生产许可证、经营许可证、ISO9001/13485认证辅导、SFDA验厂辅导、SFDA注册检测、企业标准编制、药监局自由销售证。
出口其余法规:医疗器械单一体系审核MDSAP认证、澳大利亚TGA注册、BSCI验厂辅导、ISO22716 GMPC验厂辅导、BRC 认证,口罩NELNSON(尼尔森)检测:(EN 14683检测、BFE检测,VFE检测、PFE检测)、手术衣EN13795测试
MDR&IVDR法规的变化(1)
1. 新概念和要求
Economic Operators
经销链相关方
Personal responsible for regulatory compliance
对法规符合性的人员职责
Medical Device Coordination Group MDCG
医疗器械协调小组
Expert Panel Review for High Risk Devices
*小组对高风险器械的评审
Common Specification CS(CTS)
通用规范
Reprocessing of Single-use Medical Devices
一次性医疗器械的再评审
Economic Operators
• 提出了新的概念Economic Operators经销链相关方,包括:制造商,欧盟授权代表,进口商和分销商
• 另新增加的要求:
• 各方都要明确其上游和下游的器械供应商;以及将器械直接供给的卫生机构或医疗保健人员(Article 25).
• Store and keep the UDI for implantable devices by economic operators (Article 27.8)
• Electronic system for registration of economic operators (Article 30+Annex VI, Part A)
Regulatory compliance
• It should be ensured that supervision and control of the manufacture of devices, and the post-market surveillance and vigilance activities concerning them, are carried out within the manufacturer’s organisation by a person responsible for regulatory compliance who fulfils minimum conditions of qualification.
• The authorised representative plays a pivotal role in ensuring the compliance of the devices produced by those manufacturers and in serving as their contact person established in the Union… legally liable for defective devices in the event that a manufacturer
established outside the Union has not complied with its general
obligations

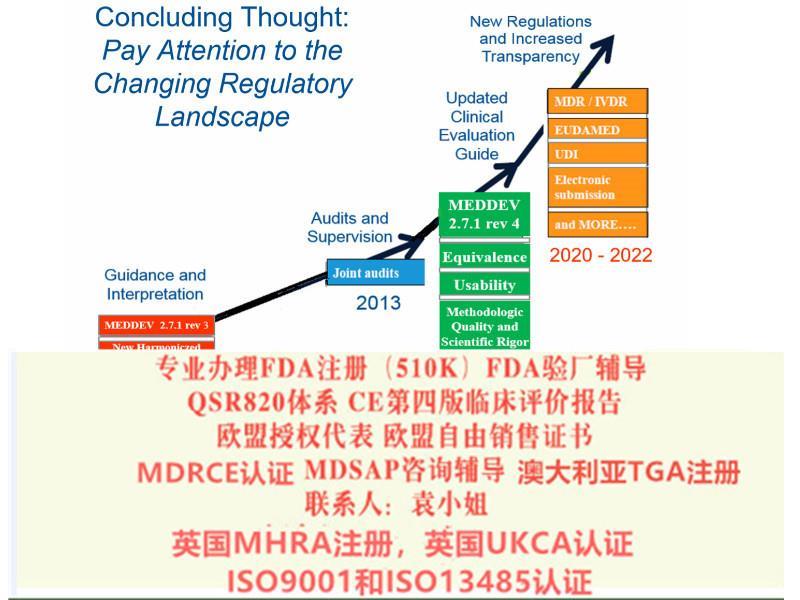
新法规将取代现行的三个医疗器械指令:分别是医疗器械指令93/42/EEC,有源医疗器械指令90/385/EEC及体外诊断医疗器械指令98/79/EEC。

2016年12月14日,EUDAMED(European databank for medical devices) 筹划指导**上欧盟各国对于医疗器械法规MDR及IVDR的执行进行了一轮的讨论,与会人员对于这两个法规的细节内容进行了讨论并达成了一致意见。在此基础上,会议对于MDR及IVDR的执行达成了如下时间表。2016年12月14日,EUDAMED(European databank for medical devices) 筹划指导**上欧盟各国对于医疗器械法规MDR及IVDR的执行进行了一轮的讨论,与会人员对于这两个法规的细节内容进行了讨论并达成了一致意见。在此基础上,会议对于MDR及IVDR的执行达成了如下时间表

办理出口:美国FDA注册(含FDA510K申请)、 FDA QSR820验厂辅导及整改、FDA警告信应对&RED LIST REMOVAL/QSR820体系辅导/OTC验厂辅导及整改、CE认证(CE整套技术文件编订、 CE四版临床评价(MEDDEV 2.7.1 Rev 4)编写)、ISO13485:2016、欧盟授权代表、欧盟自由销售证书、英国BRC认证咨询,BSCI验厂辅导;口罩NELNSON(尼尔森)检测:(EN 14683检测、BFE检测,VFE检测、PFE检测)、手术衣EN13795测试、防护服type5/6 (PPE认证咨询(89/686/EC个人防护指令辅导)。

医疗器械法规(MDR)转换期为3年,2020年5月4日起强制实行。体外诊断器械法规(IVDR)转换期为5年,2022年5月4日起强制实行
2019年2月医疗器械法规(MDR)和体外诊断医疗器械法规(IVDR)较终提案发布,2019年3月7日欧盟28个成员国一致投票表决同意欧盟采用新版的医疗器械法规(MDR)和体外诊断器械法规(IVDR)。

-/gbaaeee/-
http://sungoyuan.b2b168.com