BSI的CE MDR认证 欢迎来电垂询-需要什么材料
更新时间:2025-06-08 浏览数:183
所属行业:
咨询 管理咨询
发货地址:上海市浦东新区陆家嘴街道
产品数量:9999.00个
价格:¥9.00 元/个 起
MDRCE认证
按照Medical Device Regulation 2017/745/EU法规 做CE技术文件
我公司可以帮助您整理并建立高质量的CE技术文件
评估产品和已有技术文件的情况,识别存在的差距;
确认产品应符合的标准,并指导制造商安排相关的测试、确认;
根据制造商的具体情况,沟通并完成风险管理报告;
评估制造商的临床资料,编写临床评价报告;
编写CE技术文件或设计文档;
若需要,可以提供后续的法规新服务。
Medical Device Regulation 2017/745/EU法规是什么?
SUNGO集团凭借**网络和队伍为**客户提供法规性服务,帮助企业*贸易壁垒,在医疗器械行业尤为专长。
这主要包括:欧盟CE认证(MDD/MDR)、欧盟授权代表、医疗器械欧盟注册、欧盟自由销售证书、FDA注册(FDA510K)、FDA验厂辅导,陪审和翻译、ISO9001/ISO13485,中国药监局注册证、GMP体系辅导和生产许可证等项目。

Q:.对于QMS是否符合MDR的要求,有具体的截止日期嘛?
A:无论是已满足医疗器械指令(MDD)要求的医疗器械,还是未满足MDD的医疗器械,按照医疗器械法规(MDR)认证都需要符合MDR的要求。
MDR要求制造商能够展现出有效的质量管理体系。因此,要满足MDR的认证要求,您必须按照法规Article 120的要求,在过渡期内建立合格的质量管理体系。
Q:新MDR对分包方(contract manufacturers)有什么影响?
A:如果分包方要为他们所服务的制造商承担责任,那么他们必须*遵守法规要求。
如果分包方不需要为他们所服务的制造商承担责任,那么他们仅需代表制造商接受审核,包括飞行检查。
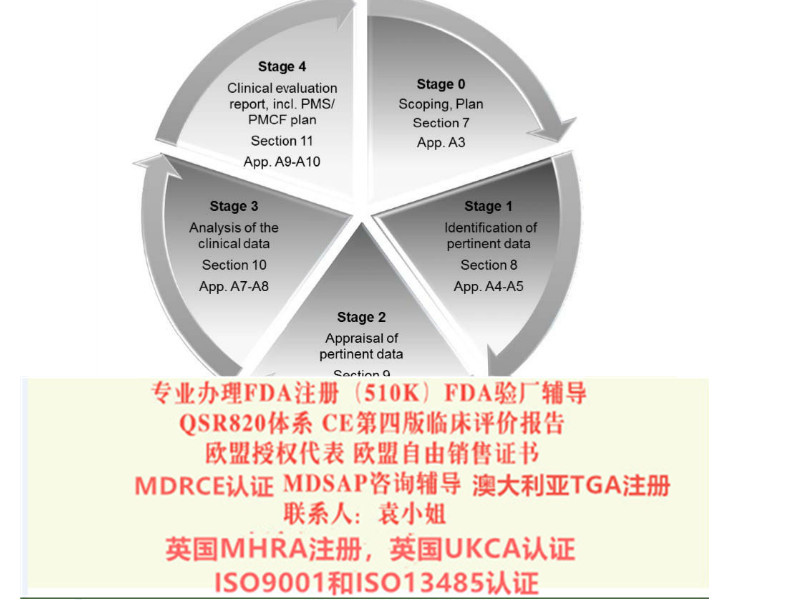
医疗器械产品如何办理新MDR法规的CE证书

-/gbaaeee/-
http://sungoyuan.b2b168.com









