CEMDR法规的欧盟授权代表公司 联系我们获取多资料-需要什么材料
更新时间:2025-04-28 浏览数:156
所属行业:
咨询 管理咨询
发货地址:上海市浦东新区陆家嘴街道
产品数量:9999.00个
价格:¥13818100000.00 元/个 起
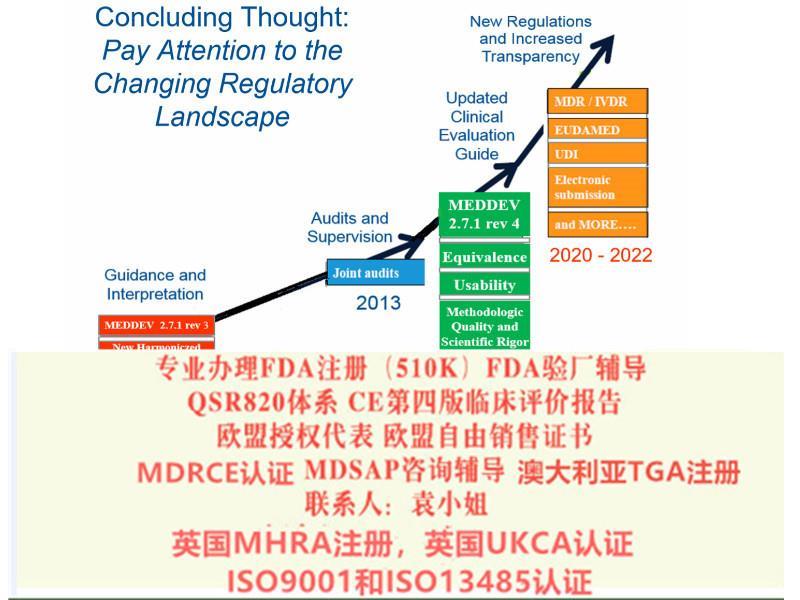
2019 年4 月5 日,欧洲议会和理事会正式签发了欧盟关于医疗器械2019/745 号法规
公告机构何时开始按照MDR进行符合性评审?
办理欧盟CE认证(CE整套技术文件编订、 CE四版临床评价(MEDDEV 2.7.1 Rev 4)编写)、ISO13485:2016认证、欧盟授权代表(德国,英国和荷兰)、欧盟注册、欧盟自由销售证书
2019年2月医疗器械法规(MDR)和体外诊断医疗器械法规(IVDR)较终提案发布,2019年3月7日欧盟28个成员国一致投票表决同意欧盟采用新版的医疗器械法规(MDR)和体外诊断器械法规(IVDR)。2019年5月5日,欧盟正式发布了OfficialJournal其正式对外宣布了新版MDR(REGULATIONEU2019/745)法规和新的IVDR(REGULATIONEU2019/746)法规。新法规将取代现行的三个医疗器械指令:分别是医疗器械指令93/42/EEC,有源医疗器械指令90/385/EEC及体外诊断医疗器械指令98/79/EEC。
2019年5月5日欧盟发布OfficialJournal
在这里我司需要特别说明的是欧盟此次是直接发布的Regulation(法规)而相比较之前的Directive(指令)其区别在于:提高了文件的约束力,发布立即在欧盟成员国生效并成为有约束力的法律,此次的Regulation*向Directive那样需要经过成员国转化成当地法律法规去落实实施。
医疗器械法规(MDR)转换期为3年,2020年5月4日起强制实行。体外诊断器械法规(IVDR)转换期为5年,2022年5月4日起强制实行。MDR将有源医疗器械指令(现行的90/385/EEC)纳入了进来,与一般医疗器械指令(现行93/42/EEC)合二为一,IVDR直接取代了现行的体外诊断医疗器械指令98/79/EEC。
我司注意到新法规主要在以下几点上发生了变化:
1.医疗器械的定义;
2.医疗器械的分类;
3.基本*和性能要求;
4.技术文件要求;
5.临床评价;
6.上市后监管;
7.Eudamed数据库;
8.对NB公告机构的监管要求(新法规生效后NB将按照新的资质要求重新进行授权);
9.对高风险医疗器械的新增了要求;
总的说来新的MDR和IVDR加强了体系管理,对高风险设备增加了相关规定比如对于非医疗用途但具有与医疗器械相似特性的设备也将受到新法规的管辖(如用于美容的彩色隐形眼镜),提升了产品对患者的透明度和可追溯性并设立电子数据库(Eudamed)、医疗设备将有一个一的识别号这加强其在整个供应链的可追溯性。
SUNGO提醒我们的客户在申请医疗产品CE认证时,在过渡阶段请谨慎考虑是选用较新法规还是采用老的指令方案,同时也需要对NB机构的发证资格进行了解和确认以保证产品在欧盟市场销售的可延续性。

什么是MDRCE证书,编写MDRCE技术文件需要多少钱
-/gbaaeee/-
http://sungoyuan.b2b168.com









