办理出口:美国FDA注册(含FDA510K申请)、 FDA QSR820验厂辅导及整改、FDA警告信应对&RED LIST REMOVAL/QSR820体系辅导/OTC验厂辅导及整改、CE认证(CE整套技术文件编订、 CE四版临床评价(MEDDEV 2.7.1 Rev 4)编写)、ISO13485:2016、欧盟授权代表、欧盟自由销售证书、英国BRC认证咨询,BSCI验厂辅导;口罩NELNSON(尼尔森)检测:(EN 14683检测、BFE检测,VFE检测、PFE检测)、手术衣EN13795测试、防护服type5/6 (PPE认证咨询(89/686/EC个人防护指令辅导)。
我们可以为您提供的自主服务项目主要有:
出口欧洲法规:欧盟CE认证(CE整套技术文件编订、 CE四版临床评价(MEDDEV 2.7.1 Rev 4)编写)、ISO13485:2016认证、欧盟授权代表(德国,英国和荷兰)、欧盟注册、欧盟自由销售证书、防护服PPE指令Type5/6认证
出口美国法规:医疗器械、化妆品、食品美国FDA注册(含FDA510K申请)、美国代理人、 FDA 验厂辅导及整改、FDA警告信应对&RED LIST REMOVAL、QSR820体系辅导、食品FDA验厂辅导及整改、OTC药品FDA验厂辅导及整改
中国法规:医疗器械产品备案登记表、医疗器械产品注册证、生产备案登记表、生产许可证、经营许可证、ISO9001/13485认证辅导、SFDA验厂辅导、SFDA注册检测、企业标准编制、药监局自由销售证。
出口其余法规:医疗器械单一体系审核MDSAP认证、澳大利亚TGA注册、BSCI验厂辅导、ISO22716 GMPC验厂辅导、BRC 认证,口罩NELNSON(尼尔森)检测:(EN 14683检测、BFE检测,VFE检测、PFE检测)、手术衣EN13795测试
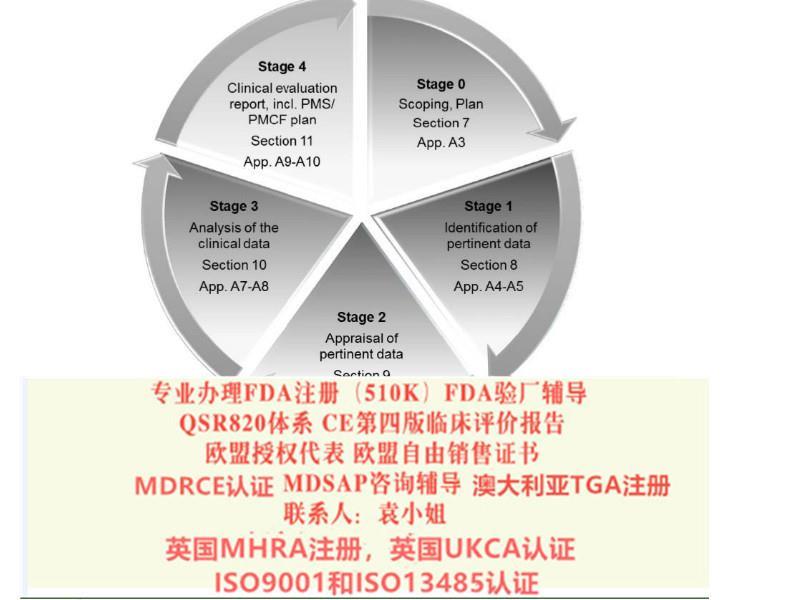
MDR&IVDR法规的变化(1)
1. 新概念和要求
Economic Operators
经销链相关方
Personal responsible for regulatory compliance
对法规符合性的人员职责
Medical Device Coordination Group MDCG
医疗器械协调小组
Expert Panel Review for High Risk Devices
*小组对高风险器械的评审
Common Specification CS(CTS)
通用规范
Reprocessing of Single-use Medical Devices
一次性医疗器械的再评审
Economic Operators
• 提出了新的概念Economic Operators经销链相关方,包括:制造商,欧盟授权代表,进口商和分销商
• 另新增加的要求:
• 各方都要明确其上游和下游的器械供应商;以及将器械直接供给的卫生机构或医疗保健人员(Article 25).
• Store and keep the UDI for implantable devices by economic operators (Article 27.8)
• Electronic system for registration of economic operators (Article 30+Annex VI, Part A)
Regulatory compliance
• It should be ensured that supervision and control of the manufacture of devices, and the post-market surveillance and vigilance activities concerning them, are carried out within the manufacturer’s organisation by a person responsible for regulatory compliance who fulfils minimum conditions of qualification.
• The authorised representative plays a pivotal role in ensuring the compliance of the devices produced by those manufacturers and in serving as their contact person established in the Union… legally liable for defective devices in the event that a manufacturer
established outside the Union has not complied with its general
obligations

我们可以为您提供的自主服务项目主要有:
出口欧洲法规:欧盟CE认证(CE整套技术文件编订、 CE四版临床评价(MEDDEV 2.7.1 Rev 4)编写)、ISO13485:2016认证、欧盟授权代表(德国,英国和荷兰)、欧盟注册、欧盟自由销售证书、防护服PPE指令Type5/6认证
出口美国法规:医疗器械、化妆品、食品美国FDA注册(含FDA510K申请)、美国代理人、 FDA 验厂辅导及整改、FDA警告信应对&RED LIST REMOVAL、QSR820体系辅导、食品FDA验厂辅导及整改、OTC药品FDA验厂辅导及整改
中国法规:医疗器械产品备案登记表、医疗器械产品注册证、生产备案登记表、生产许可证、经营许可证、ISO9001/13485认证辅导、SFDA验厂辅导、SFDA注册检测、企业标准编制、药监局自由销售证。
出口其余法规:医疗器械单一体系审核MDSAP认证、澳大利亚TGA注册、BSCI验厂辅导、ISO22716 GMPC验厂辅导、BRC 认证,口罩NELNSON(尼尔森)检测:(EN 14683检测、BFE检测,VFE检测、PFE检测)、手术衣EN13795测试
MDR&IVDR法规的变化(2)
2. 新增和细化医疗器械分类
- 22个分类规则,增加了4个规则。
新增software分类
新增用于灭菌的器械
新增利用无活性的人类组织或细胞,
或其衍生物制造的器械
新增由纳米材料合成或制成的器械
部分以美容为目的的产品纳入医疗
器械进行管理
3 .变CE符合评估途径
Annex IX Conformity assessment based on
a QMS and assessment of the T.D.
Annex X Conformity based on type examination
Annex XI Conformity based on product conformity verification

我们可以为您提供的自主服务项目主要有:
出口欧洲法规:欧盟CE认证(CE整套技术文件编订、 CE四版临床评价(MEDDEV 2.7.1 Rev 4)编写)、ISO13485:2016认证、欧盟授权代表(德国,英国和荷兰)、欧盟注册、欧盟自由销售证书、防护服PPE指令Type5/6认证
出口美国法规:医疗器械、化妆品、食品美国FDA注册(含FDA510K申请)、美国代理人、 FDA 验厂辅导及整改、FDA警告信应对&RED LIST REMOVAL、QSR820体系辅导、食品FDA验厂辅导及整改、OTC药品FDA验厂辅导及整改
中国法规:医疗器械产品备案登记表、医疗器械产品注册证、生产备案登记表、生产许可证、经营许可证、ISO9001/13485认证辅导、SFDA验厂辅导、SFDA注册检测、企业标准编制、药监局自由销售证。
出口其余法规:医疗器械单一体系审核MDSAP认证、澳大利亚TGA注册、BSCI验厂辅导、ISO22716 GMPC验厂辅导、BRC 认证,口罩NELNSON(尼尔森)检测:(EN 14683检测、BFE检测,VFE检测、PFE检测)、手术衣EN13795测试
经销商:
- 应确认产品上已正确使用CE标志、制造商已经签署符合性声明、标签说明书语言符合法规要求、已正确使用UDI;
- 应确认产品包装或其随机文件上有进口商的信息;
- 应确保器械在符合生产商要求的环境里存储和运输;
- 应对客户投诉、召回、不合格品记录在案,并通知生产商及欧盟代表;
- 认为产品不符合MDR&IVDR要求的,应立即通知制造商或欧盟代表或进口商;如果涉及严重风险的,应立即通知主管当局。
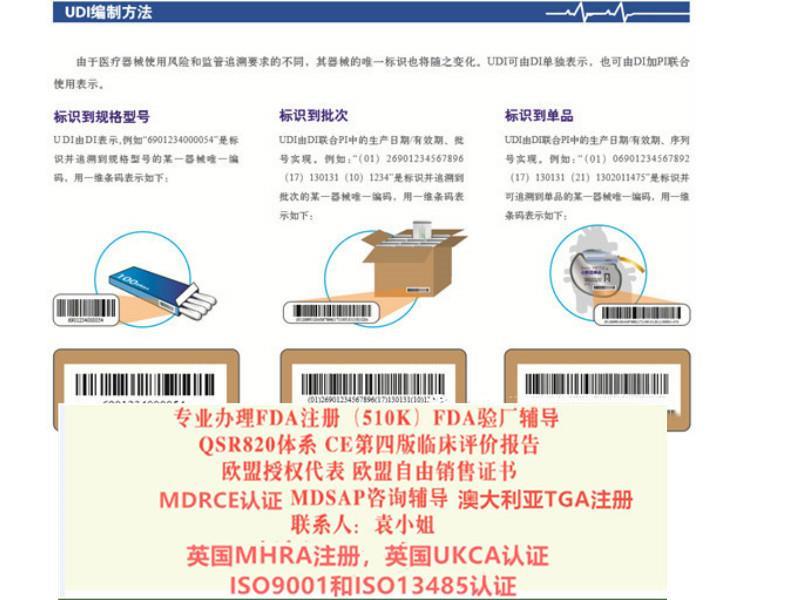
UDI-一器械识别码
UDI是Unique Device Identification的缩写,是显示在产品标签上的一组条形码或二维码,由器械识别码DI和生产识别码PI组成,前者包括制造商和产品名称信息,后者包括产品批号、有效期等信息;
制造商发货、进口商验收、销售商收货时都需要扫描UDI,
数据在UDI数据库中保存,从而实现产品全程可追溯;
UDI中的Basic UDI-DI也将出现在
制造商签发的CE符合性声明中,
也会显示在CE证书上;
欧盟授权GS1、HIBCC、ICCBBA
这三家美国公司管理UDI,制造
商应自行向三家机构申请产品的
-/gbaaeee/-
http://sungoyuan.b2b168.com