服务专业讲解
优势执行力高
价格合理优惠
特点量身定制
周期短
项目ce-mdr
地区全国
标准一站式全包服务
售后服务包售后
MDR实施之后,在三年过渡期内仍然可以按照MDD和AIMDD申请CE证书并保持证书的有效性。依据Article 120 clause2 的规定,过渡期内NB签发的CE证书继续有效,但是从其交付日期起有效期不**过5年,并且于2024年5月27日失效
MDR已从指令升级为,这增强了其对欧盟成员国的约束力,并具有直接约束力。*各国转换为国家法律法规即可实施。在内容方面,MDR基于原始指令的整合,大大改进了医疗器械认证的规范和限制,例如产品分类规则,设备可追溯性,性能研究规范,上市后产品*性提高以及有效性方面和。 MDR由10章和123篇文章组成,共17个附录。
关于的过渡期:
仅拥有根据指令90/385/EEC和93/42/EEC颁发的证书的设备可以投放市场,前提是自MDR应用之日起设计和预期用途没有发生重大变化且符合要求新规定。,市场监督,警报,经济运营和设备登记的规定。
可通过免税订单获得,符合新规定的设备可在2020年5月26日前投放市场。符合新规定的合格评定机构可在2020年5月26日前并通知。可以采用合规合规评估程序,并在2020年5月26日之前根据新规定颁发证书。
什么是合格评定?
产品在投放市场之前要进行合格性评估
需要满足所有立法要求
包括测试,检查和认证
适用产品法规中规定了每种产品的程序
合格评定的目的:
为了投放市场的产品符合所有法规要求
该程序应确保消费者,公共当局和制造商对产品的一致性充满信心

Q:MDR何时生效?
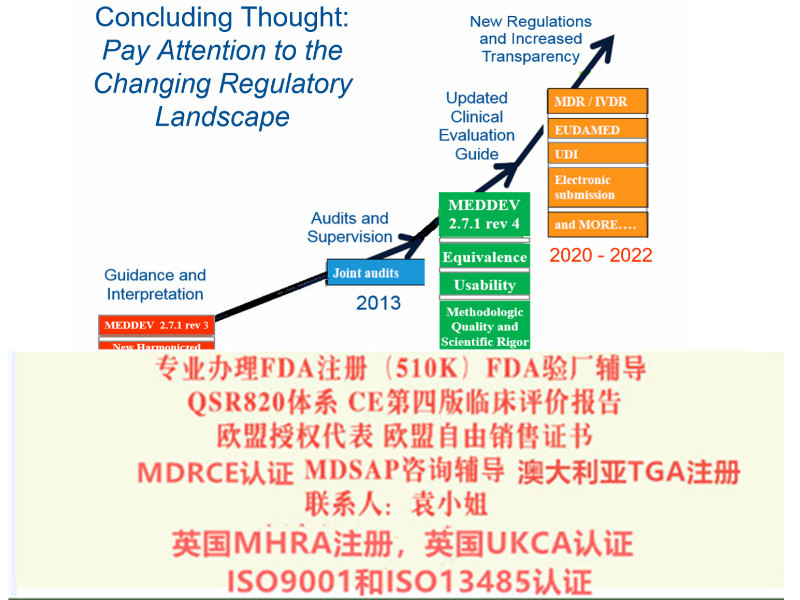
A:2017年5月5日,欧盟正式发布了欧盟器械法规(MDR)。2017年5月25日,MDR正式生效。
器械指令MDD(93/42/EEC)和有源植入类器械指令AIMDD(90/385/EEC)被器械法规MDR(EU 2017/745)取代,法规过渡期为3年。
制造商应在过渡期内更新技术文件和流程以满足法规要求。具体可以参阅法规Article 120中若干过渡条款的要求。
Q:MDR的新要求是否可以延后执行?
A:不可以, MDR覆盖的所有产品都必须满足新法规的要求。过渡期结束后,不符合MDR要求的产品不可在欧盟上市。
Medical Device Regulation 2017/745/EU法规是什么?
SUNGO集团凭借**网络和队伍为**客户提供法规,帮助企业*贸易壁垒,在器械行业尤为专长。
这主要包括:欧盟CE认证(MDD/MDR)、欧盟授权代表、器械欧盟注册、欧盟自由销售证书、FDA注册(FDA510K)、FDA验厂,陪审和翻译、ISO9001/ISO13485,中国局注册证、GMP体系和生产许可证等项目。

2017年5月5日欧盟就发布了新版器械法规MDR(EU 2017/745)。在2017年5月25日,MDR正式生效。老的器械指令即MDD( 93/42/EEC)与新的MDR(EU 2017/745)指令的交替过渡期为三年。
也就是说从2020年5月26日, MDR指令在欧盟就将开始强制执行,它将完全取代过去老的器械指令MDD (93/42/EEC)和老的有源植入器械指令AIMDD(90/385/EEC)。
需要特别指出的是:
☑ MDR强制执行后,新申请的CE认证必须按照MDR执行;
☑ 当前没有CE证书的产品,自5月27日起,必须按照MDR认证;
☑ 2020年5月26前签发的MDD证书,在有效期内仍然可以用,晚到2024年5月26日;
☑ 原有MDD证书需在证书失效前换发 MDR。
1. 本次爆发期间所获CE认证的医用口罩,可以说95%以上的都是按照老的MDD指令进行的,可能要面临新版换证问题;
2. 根据目前欧盟统计,拥有老指令版本MDD(93/42/EEC)授权的NB公告机构共有56家,而符合MDR授权的NB公告机构目前则仅有12家而已。也就是说,从2020年5月26日开始,针对医用口罩的CE认证审核机构可选性降低了80%;
3. 由于欧盟MDR此类授权审核机构(NB:Notified Body)可选性的减少,必然造成医用口罩CE认证费用相当大的概率将有大幅提升的可能;
4. 新版MDR指令审核要求比老版MDD指令更为复杂,认证周期必然大幅度拉长,本次期间有些机构声称的几天*的可能性将基本为零;
5. 获得CE认证的口罩等设备必须要求有的欧盟授权代表(简称"欧代"),这在以前MDD指令时对一些低风险产品其实有没有欧代并不严格,但在MDR指令后,即使是在一些电商平台上进行销售的产品也会要求提供必要的欧代信息;
6. MDR的体系审核流程和要求更为复杂与繁琐,举个例子如在MDR条款15中要求,器械厂商应在其组织架构内,至少配备一名负责合规的人员,即合规负责人(Person responsible for regulatory compliance)。该人员应具备器械领域的必要知识,并且有一系列的性要求(如法律、、、工程或其他相关学科,并且至少拥有一年与器械法规事务或质量管理体系相关的经验)。
7. 对于已经在欧盟渠道正式上市的产品来说,老的MDD指令CE证书可以保持到2024年5月26日。但如果企业产品在今年5月26日前,并未在欧盟市场销售的,原则上在今年5月26日后应该将老的MDD证书重新申请调整到MDR版本。
http://sungoyuan.b2b168.com









