品牌SUNGO
欧代荷兰
周期4周
有效期5年
流程SUNGO
评估及更新质量管理体系(以下*3点) 检查可用证据和风险管理的充分性,识别差异(*56条) 评估产品标签(附件I*Il1章) 确保上市后监督的安排充分适宜够(*七章*1节) 制定上市后性能跟踪(PMCF,附件XIV B部分) 做好迎接新的警戒需求的规定(*七章*二节) 确保可追溯相关方面的义务(*3章) 3,质量体系评估 评估新IVDR法规下QMS符合标准和流程的程度 增加新法规应用于QMS的要求 协助和识别合规负责人(PPRC)并参与培训 4,公告机构NB确认 选择合适的公告机构,确认公告机构资质及范围
2017年5月5日欧盟发布OfficialJournal在这里我司需要特别说明的是欧盟此次是直接发布的Regulation(法规)而相比较之前的Directive(指令)其区别在于:提高了文件的约束力,发布立即在欧盟成员国生效并成为有约束力的法律,此次的Regulation*向Directive那样需要经过成员国转化成当地法律法规去落实实施。器械法规(MDR)转换期为3年,2020年5月4日起强制实行。

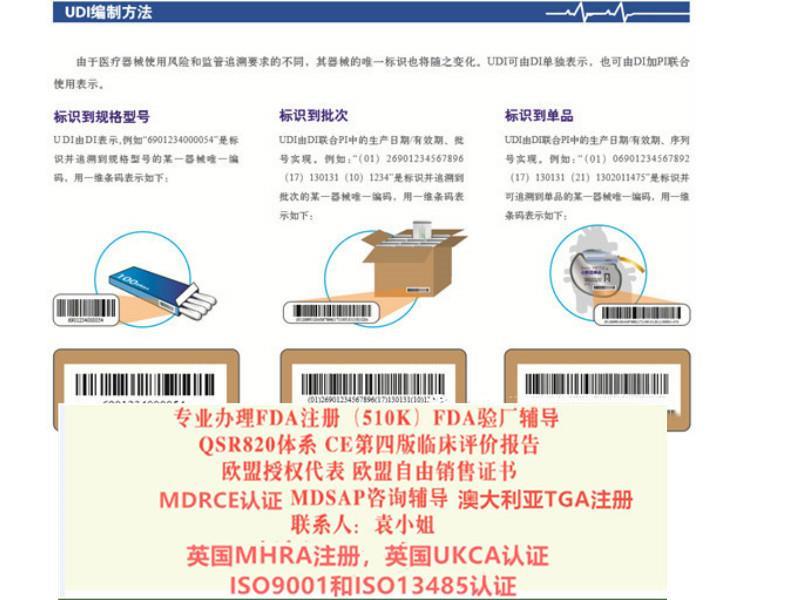
申请出口:美国FDA注册(含FDA510K申请)、 FDA QSR820验厂及整改、FDA警告信应对&RED LIST REMOVAL/QSR820体系/OTC验厂及整改、CE认证(CE整套技术文件编订、 CE*四版评价(MEDDEV 2.7.1 Rev 4)编写)、ISO13485:2016、欧盟授权代表、欧盟自由销售证书、英国BRC认证咨询,BSCI验厂;口罩NELNSON(尼尔森)检测:(EN 14683检测、BFE检测,VFE检测、PFE检测)、手术衣EN13795测试、防护服type5/6 (PPE认证咨询(89/686/EC个人防护指令)。

我们可以为您提供的自主服务项目主要有:
出口欧洲法规:欧盟CE认证(CE整套技术文件编订、 CE*四版评价(MEDDEV 2.7.1 Rev 4)编写)、ISO13485:2016认证、欧盟授权代表(德国,英国和荷兰)、欧盟注册、欧盟自由销售证书、防护服PPE指令Type5/6认证
出口美国法规:器械、化妆品、食品美国FDA注册(含FDA510K申请)、美国代理人、 FDA 验厂及整改、FDA警告信应对&RED LIST REMOVAL、QSR820体系、食品FDA验厂及整改、OTC药品FDA验厂及整改
中国法规:器械产品备案登记表、器械产品注册证、生产备案登记表、生产许可证、经营许可证、ISO9001/13485认证、SFDA验厂、SFDA注册检测、企业标准编制、局自由销售证。
出口其余国际法规:器械单一体系审核MDSAP认证、澳大利亚TGA注册、BSCI验厂、ISO22716 GMPC验厂、BRC 认证,口罩NELNSON(尼尔森)检测:(EN 14683检测、BFE检测,VFE检测、PFE检测)、手术衣EN13795测试
解读MDR系列讨论 部分:MDR演变过程和MDR的过渡期MDR演变过程近两年,国内外器械法规变化巨大,对于器械厂家及从业人员来说,都面临着比较大的挑战,针对明年将要实施的欧盟器械新法规2017/745/EU MDR,小编精心为大家准备了解读MDR系列,旨在为从业的朋友们提供有价值的参考信息。
手术衣510K,隔离衣510K,手套510K,电动/手动轮椅510K,FDA注册,FDA美国代理人
http://sungoyuan.b2b168.com









