检查手套MDR2017/745认证介绍 医疗器械新MDR认证知识
更新时间:2025-06-01 浏览数:32
所属行业:
咨询 管理咨询
发货地址:上海市金山区
产品数量:9999.00个
价格:面议
周期4周
费用SUNGO
品牌SUNGO
欧代荷兰
注册CIBG注册
在此期间,仍然可以进行以下MDD证书的相关活动,例如产品变更及一年期内MDD新户的申请;现有MDD客户证书更新的相关活动;现有MDD客户证书更新的申请(包括提前更新的申请);
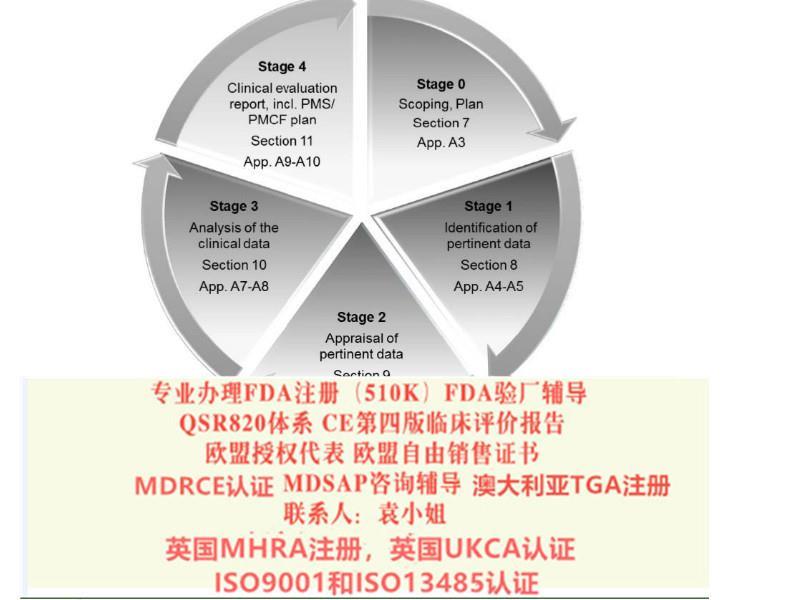
申请欧盟CE认证(CE整套技术文件编订、 CE*四版评价(MEDDEV 2.7.1 Rev 4)编写)、ISO13485:2016认证、欧盟授权代表(德国,英国和荷兰)、欧盟注册、欧盟自由销售证书
器械法规(MDR)转换期为3年,2020年5月4日起强制实行。体外诊断器械法规(IVDR)转换期为5年,2022年5月4日起强制实行。MDR将有源器械指令(现行的90/385/EEC)纳入了进来,与一般器械指令(现行93/42/EEC)合二为一,IVDR直接取代了现行的体外诊断器械指令98/79/EEC。
注意到新法规主要在以下几点上发生了变化:
1.器械的定义;
2.器械的分类;
3.基本和性能要求;
4.技术文件要求;
5.评价;
6.上市后;
7.Eudamed数据库;
8.对NB公告机构的要求(新法规生效后NB将按照新的资质要求重新进行授权);

申请欧盟CE认证(CE整套技术文件编订、 CE*四版评价(MEDDEV 2.7.1 Rev 4)编写)、ISO13485:2016认证、欧盟授权代表(德国,英国和荷兰)、欧盟注册、欧盟自由销售证书
欧盟普通器械条例MDR法规EU 2019/745详解(上)
B 设计和制造相关的要求
• 10)化学、物理和生物特性

2017年2月器械法规(MDR)和体外诊断器械法规(IVDR)终提案发布,2017年3月7日欧盟28个成员国一致表决同意欧盟采用新版的器械法规(MDR)和体外诊断器械法规(IVDR)。

对于变更事项的规定,欧盟法规更接近产品本身,如涉及设计或特性的更改、协调标准更改等,使得变更事项更为明确。另外,欧盟在符合性评估过程中允许产品发生变化,相比于中国法规审评审批过程中无法变更的要求,这种方式更为灵活;充分利用UDI 及电子数据系统等工具, 从欧盟法规层面规定了电子系统的建立和使用要求,从而增加器械上市的透明度和可追溯性。
SUNGO服务的宗旨不仅是完成项目,而是帮助客户解决问题并达成目标。
http://sungoyuan.b2b168.com