检查手套CE MDR认证 mdr认证 MDR CE认证的重点以及MDRCE常见问题解答
更新时间:2025-04-20 浏览数:17
所属行业:
咨询 管理咨询
发货地址:上海市金山区
产品数量:9999.00个
价格:面议
服务专业讲解
优势执行力高
价格合理优惠
特点量身定制
周期短
项目ce-mdr
地区全国
标准一站式全包服务
售后服务包售后
*17条规定,一次性器械的再利用只能在相应的国家法律允许的情况下进行,并应符合MDR规定。任何重新处理一次性设备或重新使用它的自然人或法人应被视为多路复用设备的制造商,并应承担制造商的义务,包括设备的可追溯性。但是,目前只有一些欧盟成员国接受设备再利用并有相应的规定。
欧盟授权代表、MDD/MDR CE认证咨询、新版评估报告编写服务
MDR的主要变化:
1.扩大申请范围
2.提出的新概念和设备定义
3.优化器械的分类
4.提高设备的一般*性和性能要求
5.加强对技术文件的要求
6.设备上市后加强监督
7.提高评估的相关要求
8.建议建立和使用Eudamed数据库
9.提出设备可追溯性(UDI)
10. NB的严格要求

Directives 指令规定了必须达到的某些结果,是指设定所有欧盟成员国必须实现的目标的立法行为。但是,每个成员国都可以自由决定如何将指令转换为法律。
Regulations 法规是具有约束力的立法行为,对所有成员国都有直接影响。
合格评定程序:
制造商只能在满足所有适用要求的情况下才能将产品投放到欧盟市场。合格评定程序是在产品可以出售之前进行的。欧盟会的主要目标是帮助确保不*或不合规的产品进入欧盟市场。
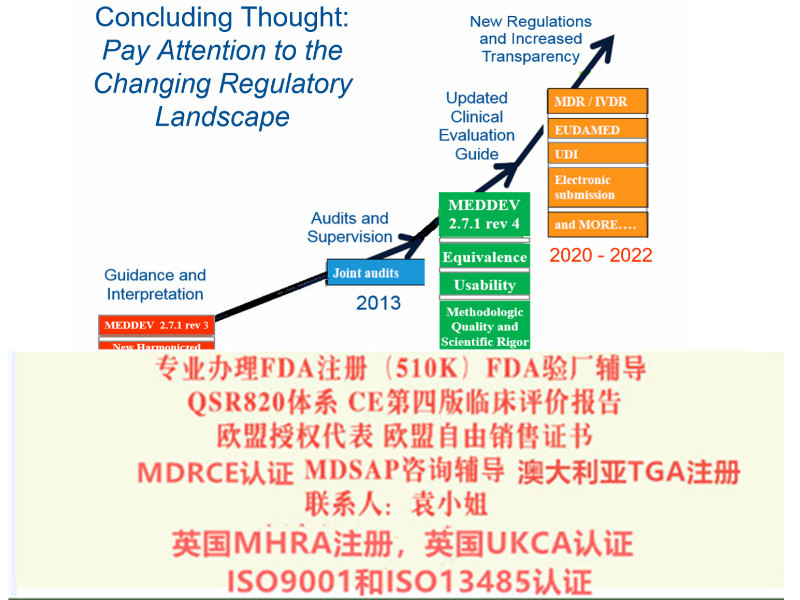
Q:.对于QMS是否符合MDR的要求,有具体的截止日期嘛?
A:无论是已满足器械指令(MDD)要求的器械,还是未满足MDD的器械,按照器械法规(MDR)认证都需要符合MDR的要求。
MDR要求制造商能够展现出有效的质量管理体系。因此,要满足MDR的认证要求,您必须按照法规Article 120的要求,在过渡期内建立合格的质量管理体系。
Q:新MDR对分包方(contract manufacturers)有什么影响?
A:如果分包方要为他们所服务的制造商承担责任,那么他们必须*遵守法规要求。
如果分包方不需要为他们所服务的制造商承担责任,那么他们仅需代表制造商接受审核,包括飞行检查。

技术文档应包含哪些内容?
制造商的姓名和地址,或授权代表的姓名和地址
产品简要说明
产品标识,例如产品序列号
产品设计和制造所涉及的设施的名称和地址
评估产品合格性的机构的名称和地址(如适用)
欧盟符合性声明DoC
标签和使用说明
产品符合的相关法规声明
确定要求遵守的技术标准
零件清单
检测结果
http://sungoyuan.b2b168.com









