电动移位机2017/745 MDR 2017/745号法规附
更新时间:2025-09-13 浏览数:31
所属行业:
咨询 管理咨询
发货地址:上海市金山区
产品数量:9999.00个
价格:面议
品牌SUNGO
欧代荷兰
周期4周
注册CIBG
有效期5年
个人防护类防护服:非医用防护服可以按照个人防护用品出口到欧盟,需要满足(EU)2016/425(PPE)指令。PPE将个人防护产品分为I类、II类、III类产品。
当公告机构现场审核或者文件审核开具不符合时,我们提供整改服务,确*整改验证。项目背景()欧洲议会和理事会于2017 年4 月5 日签发的关于器械*2017/745 号法规, 修订了*2001/83/EC 号指令,*178/2002 号(EU)法规和*1223/2009 号(EU)法规,并废除了理事会*90/385/EEC 号和*93/42/EEC 号指令.MDR实施之后,在三年过渡期内仍然可以按照MDD和AIMDD申请CE证书并保持证书的有效性。依据Article 120 clause2 的规定,过渡期内NB签发的CE证书继续有效。
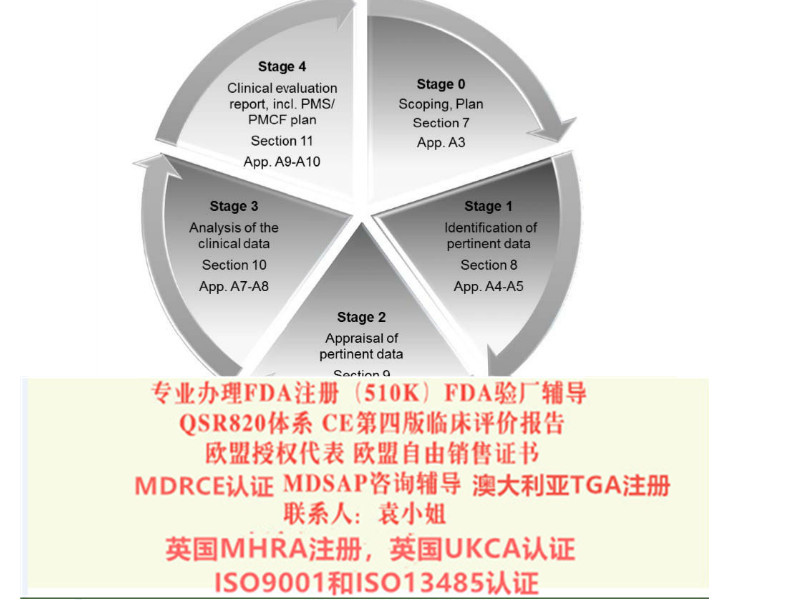
CE认证策略咨询 协助您判定产品分类 协助您选择合理的符合性途径 协助您选则合适的公告机构 测试服务,或者向您的推荐合适的测试机构 根据我们的经验,为您制定认证的解决方案 协助您完成评估 为您编写CE技术文件 欧盟代表服务CE MDR认证中REGULATION (EU) 2017/745,简称“MDR”根据TUV莱茵消息,5月份以后将不再接MDD指令的CE订单,且现在接的订单企业必须在8月31日之前接受审核。由此可见,接下来将会是II类CE的一个申请高峰期,毕竟MDR的费用会比MDD高很多。

MDR实施之后,在三年过渡期内仍然可以按照MDD和AIMDD申请CE证书并保持证书的有效性。依据Article 120 clause2 的规定,过渡期内NB签发的CE证书继续有效,但是从其交付日期起有效期不**过5年,并且于2024年5月27日失效MDR已从指令升级为,这增强了其对欧盟成员国的约束力,并具有直接约束力。

在上市后要求中,经济运营商同时负有相应的责任和义务。法规对各方义务的描述更为明确也更为具体,对于制造商的要求更为细化,因此新法规执行后,各方应先明确自身职责和义务,规范有序地开展生产和市场活动,应审核确认上游供应商是否符合规定,并确认能够自己的下游流程符合规定,应按照对应的警戒系统的要求进行或配合事件上报,配合完成现场纠正措施,并依据职责组织培训。法规中规定了对于一次性使用器械的再处理即复用的要求。
SUNGO服务的宗旨不仅是完成项目,而是帮助客户解决问题并达成目标。
http://sungoyuan.b2b168.com









