PVC 导尿管出口CE认证 MDR 2017/745医疗器械法规
更新时间:2025-06-03 浏览数:79
所属行业:
咨询 管理咨询
发货地址:上海市金山区
产品数量:9999.00个
价格:面议
周期4周
费用SUNGO
品牌SUNGO
欧代荷兰
注册CIBG注册
欧盟授权代表的名称和地址必须器械随附的信息上,例如(包装)标签和使用说明。如果发生事故,欧盟授权代表将协助并协调向主管当局报告事件。
申请欧盟CE认证(CE整套技术文件编订、 CE*四版评价(MEDDEV 2.7.1 Rev 4)编写)、ISO13485:2016认证、欧盟授权代表(德国,英国和荷兰)、欧盟注册、欧盟自由销售证书
MDR&IVDR法规的变化(2)
2. 新增和细化器械分类
- 22个分类规则,增加了4个规则。
属于IIb类。

2019 年4 月5 日,欧洲议会和理事会正式签发了欧盟关于器械*2019/745 号法规

关于欧盟MDR法规的CE技术文件编订和认证
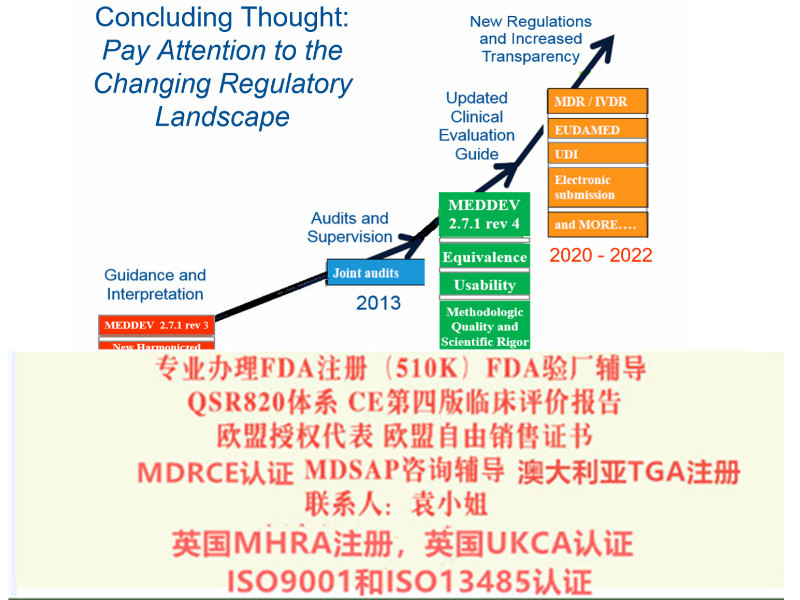
2017 年4 月5 日,欧洲议会和理事会正式签发了欧盟关于器械*2017/745 号法规(MDR,EU2017/745),5月5日,欧盟(Official Journal of the EuropeanUnion) 正式发布该法规。2017 年5 月25 日,MDR 正式生效, 替代了原器械指令(MDD,93/42/EEC)和主动植入式器械指令(AIMD,90/385/EEC)。
MDR 由指令升级为法规,提高了对欧盟成员国的约束力,具有直接约束性,*各国转化为本国的法律法规的形式即可落实实施。内容上,MDR 在整合原指令的基础上,大幅提升了有关医疗器械认证的规范和限制,例如关于产品分类规则、器械的可追溯性、性能研究的规范、增加上市后的产品*性和有效性的等方面。MDR 共10 章123 条,并附有17 个附录。
一、关于法规过渡期
MDR 过渡期为3 年,共涉及四个时间点(见表1):
欧盟器械新法规MDR主要变化情况介绍
仅具有根据90/385/EEC 和93/42/EEC 指令签发的证书的器械可投放市场的前提是自MDR 适用之日起,其在设计和预期目的上无显著变化并符合新法规有关市场后监察、市场监察、警戒、经济运营商及器械注册的规定。
通过豁免指令的形式上市,且符合新法规的器械可在2020 年5 月26 日之前投放市场。并可在2020 年5 月26 日前并通知符合新法规的符合性评估机构。公告机构可在2020 年5 月26 日前, 采用合规的符合性评估流程并按照新法规签发证书。
SUNGO公司介绍:SUNGO创建于2006年。以助力大健康产品**流通为使命,我们致力于成为受用户信赖的合规服务机构。SUNGO的客户覆盖**洲,遍布30多个和地区,客户总数**过5000家。、、中国器械企业**过30%选择SUNGO,同时也有多家**器械企业选择SUNGO提供服务。
http://sungoyuan.b2b168.com









