

热门搜索:



起订量:1 价格:999
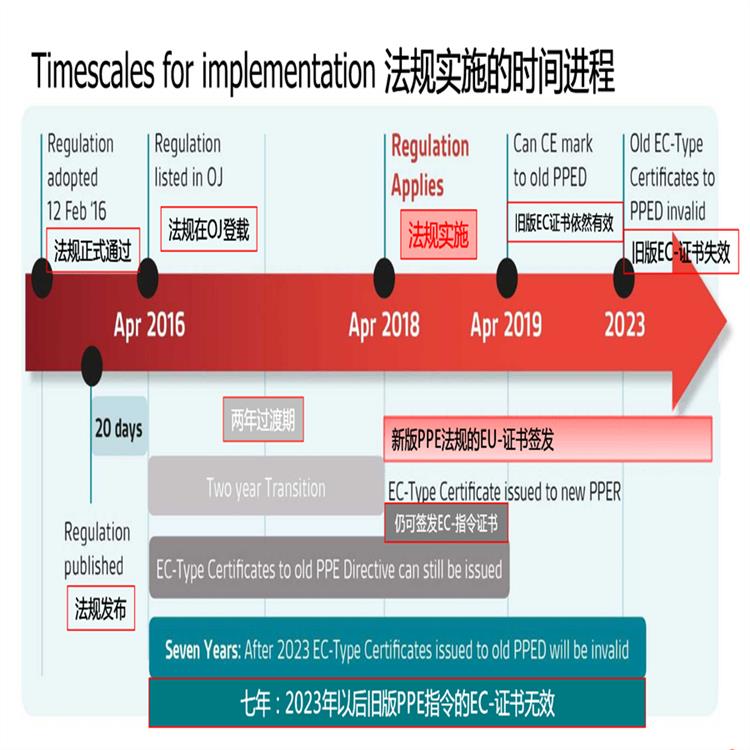
MDR于2017年5月发布,标志着MDD和AIMDD之间为期三年的过渡期的开始。在过渡期间,MDR将逐步生效,先是与公告机构和制造商根据MDR申请新证书的能力有关的规定。过渡期将于2020年5月26日,即MDR法规的“适用日期”(DoA)结束。从那时起,MDR将完全适用。

MDR适用范围MDR的范围已经扩大了,因此作为制造商,您必须检查您的产品组合,以确定与指令相比,是否有更多的设备属于法规的范围。注意附件十六所列的产品,这些产品一旦通过载列共同规格的实施细则,会纳入本规例。不属于本范围的产品清单见*6段。

体外诊断器械法规(IVDR)转换期为5年,2022年5月4日起强制实行。MDR将有源器械指令(现行的90/385/EEC)纳入了进来,与一般器械指令(现行93/42/EEC)合二为一,IVDR直接取代了现行的体外诊断器械指令98/79/EEC。主要事项:预计时间英文版MDR及英文版IVDR定稿 ,2017年一月底英文版MDR及IVDR在成员国发布欧盟其他语言MDR 及IVDR在成员国发布 ,2017年2月中欧盟会正式接受MDR及IVDR,2017年3月初欧洲议会正式接受MDR及IVDR,2017年4月初MDR及IVDR正式公开发布,017年4月底MDR及IVDR正式执行 2017年5月底MDR强制执行 ,020年5月底IVDR强制执行 , 2022年5月底MDR CE认证2016年12月14日,EUDAMED(European databank for medical devices) 筹划会上欧盟各国对于器械法规MDR及IVDR的执行进行了一轮的讨论,与会人员对于这两个法规的细节内容进行了讨论并达成了一致意见。

