周期4周
费用SUNGO
品牌SUNGO
欧代荷兰
注册CIBG注册
建立新法规实施过渡计划 5,技术文件编制 编制符合MDR要求的技术文件(TD) 编制评估报告、生物学评价报告和风险管理等技术文件等 产品设计开发流程,确保输入及输出的完整性 确认标签、上市后监督、上市后性能跟踪方案 技术文件整改(风险管理报告,性能评估报告,GSPR等) 6,QMS建立:更新现有体系中IVDR用于QMS的要求 定制企业合规QMS系统 执行体系实施计划确保覆盖各个方面及各方面责任 7, 可追溯性UDI 建立可追溯性QMS要求 建立UDI系统程序及制度 确认UDI的规划及实施
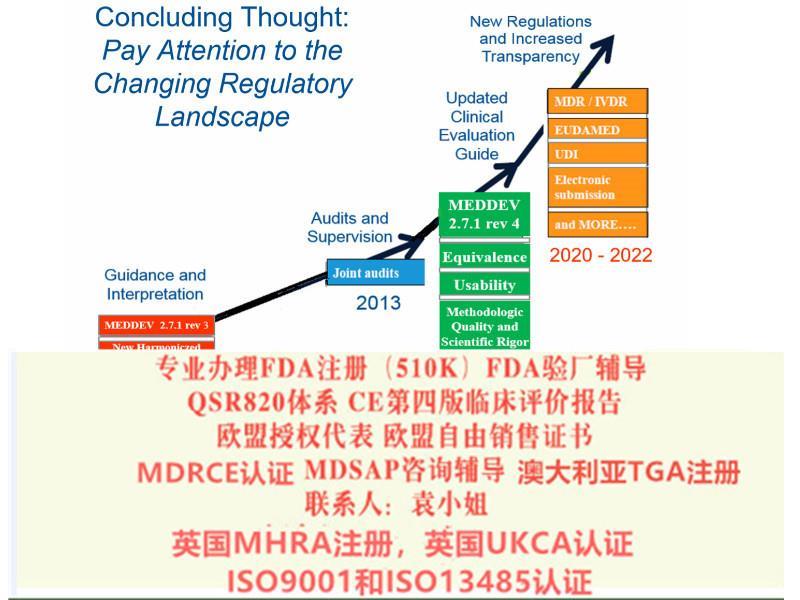
我司注意到新法规主要在以下几点上发生了变化:1.器械的定义;2.器械的分类;3.基本和性能要求;4.技术文件要求;5.评价;6.上市后;7.Eudamed数据库;8.对NB公告机构的要求(新法规生效后NB将按照新的要求重新进行授权);9.对高风险器械的新增了要求;MDR&IVDR修订要点15) 欧盟代表与进口商和制造商一起起到连带责任欧盟代表要求, 类似于法规负责人16) 平行贸 Parallel Trade, 特别是重新贴标签或重新包装17) 一次性器械的再加工和使用:- 符合成员国的法规要求- 再加工方要承担法定制造商的责任;- 由机构或外部加工方进行的一次性MD的再加工和再使用必须要符合通用技术规范或协调标准或成员国的法规要求.- 再加工器械的和性能应等同于初期的一次性MD18) 植入器械: 患者应获得基本的信息, 包括标识, 危害健康的警示或注意事项19) 带有CE标记的MD, 在欧盟内可以自由流通和销售. 但成员国可以限制某些器械的使用.20) 除了定制器械外, 所有器械都应应用UDI系统 (MDR执行后1-5年)21) EUDAMed, MD的 命名Code22) 植入和III类产品的制造商应公开产品的主要和性能, 及评估结果的概要.- 和性能的概要应特别包括该产品在与其他诊断或方法比较时的重要性,和二者的使用条件23) 在欧盟的层面上管理NB

经济运营者是指制造商,授权代表,进口商,分销商以及系统或手术袋的任何组合或。投放市场的自然人或法人。也是说,负责按照法规生产设备(包括组合或),销售和上市后操作的自然人或法人2017 年4 月5 日,欧洲议会和理事会正式签发了欧盟关于器械*2017/745 号法规(MDR,EU2017/745),5月5日,欧盟(Official Journal of the EuropeanUnion) 正式发布该法规。

CE MDR认证中REGULATION (EU) 2017/745,简称“MDR”
根据TUV莱茵新消息,5月份以后将不再接MDD指令的CE订单,且现在接的订单企业必须在8月31日之前接受审核。
由此可见,接下来将会是II类CE的一个申请高峰期,毕竟MDR的费用会比MDD高很多。
2017年5月5日,欧盟(Official Journal of the European Union)正式发布了欧盟器械法规(REGULATION (EU) 2017/745,简称“MDR”)。MDR将取代Directives 90/385/EEC (有源植入类器械指令)and 93/42/EEC(器械指令)。依据MDR Article 123的要求,MDR于2017年5月26日正式生效,并与2020年5月26日期正式取代MDD(93/42/EEC)和AIMDD(90/385/EEC)。

申请欧盟CE认证(CE整套技术文件编订、 CE*四版评价(MEDDEV 2.7.1 Rev 4)编写)、ISO13485:2016认证、欧盟授权代表(德国,英国和荷兰)、欧盟注册、欧盟自由销售证书
MDR&IVDR法规的变化(1)
经销商:
- 应确认产品上已正确使用CE标志、制造商已经签署符合性声明、标签说明书语言符合法规要求、已正确使用UDI;
- 应确认产品包装或其随机文件上有进口商的信息;
- 应确保器械在符合生产商要求的环境里存储和运输;
- 应对客户投诉、召回、不合格品记录在案,并通知生产商及欧盟代表;
- 认为产品不符合MDR&IVDR要求的,应立即通知制造商或欧盟代表或进口商;如果涉及严重风险的,应立即通知主管当局。
UDI-器械识别码
UDI是Unique Device Identification的缩写,是显示在产品标签上的一组条形码或二维码,由器械识别码DI和生产识别码PI组成,前者包括制造商和产品名称信息,后者包括产品批号、有效期等信息;
制造商发货、进口商验收、销售商收货时都需要扫描UDI,
数据在UDI数据库中保存,从而实现产品全程可追溯;
UDI中的Basic UDI-DI也将出现在
制造商签发的CE符合性声明中,
也会显示在CE证书上;
欧盟授权GS1、HIBCC、ICCBBA
这三家美国公司管理UDI,制造
商应自行向三家机构申请产品的
UDI。
我们可以为您提供的自主服务项目主要有:
出口欧洲法规:欧盟CE认证(CE整套技术文件编订、 CE*四版评价(MEDDEV 2.7.1 Rev 4)编写)、ISO13485:2016认证、欧盟授权代表(德国,英国和荷兰)、欧盟注册、欧盟自由销售证书、防护服PPE指令Type5/6认证
出口美国法规:器械、化妆品、食品美国FDA注册(含FDA510K申请)、美国代理人、 FDA 验厂及整改、FDA警告信应对&RED LIST REMOVAL、QSR820体系、食品FDA验厂及整改、OTC药品FDA验厂及整改
中国法规:器械产品备案登记表、器械产品注册证、生产备案登记表、生产许可证、经营许可证、ISO9001/13485认证、SFDA验厂、SFDA注册检测、企业标准编制、局自由销售证。
出口其余国际法规:器械单一体系审核MDSAP认证、澳大利亚TGA注册、BSCI验厂、ISO22716 GMPC验厂、BRC 认证,口罩NELNSON(尼尔森)检测:(EN 14683检测、BFE检测,VFE检测、PFE检测)、手术衣EN13795测试
所有客户均有专属服务人员,针对市场准入过程中的问题提供的支持和解答。选择SUNGO,不是选择了一次性的合作伙伴,而是选择了一个长期的技术支持的战略伙伴。
http://sungoyuan.b2b168.com