服务专业讲解
优势执行力高
价格合理优惠
特点量身定制
周期短
项目ce-mdr
地区全国
标准一站式全包服务
售后服务包售后
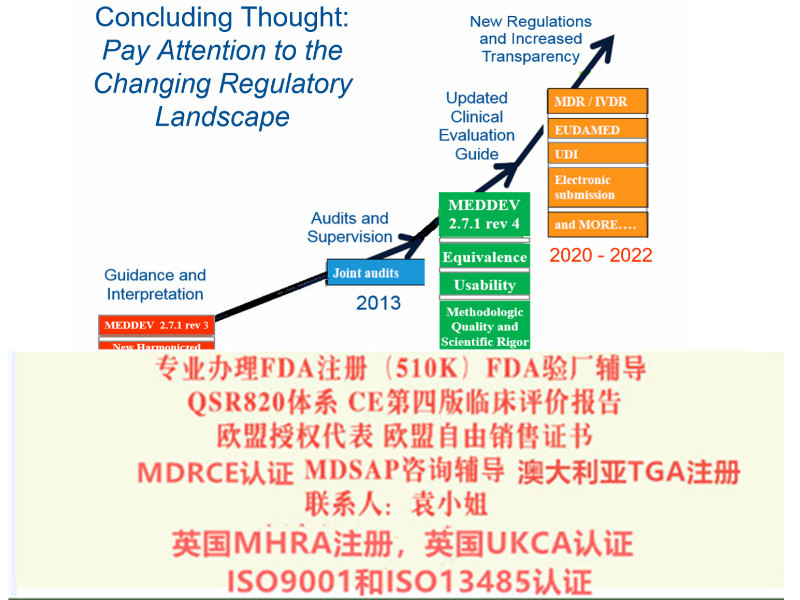
MDR法规下,I类器械(非测量、非、非重复使用)可以采用自我声明模式,但需要欧盟授权代表和欧洲注册。I类器械(测量、、重复使 用)除获得公告机构颁发的 CE和ISO13485证书外, 还需要欧盟授权代表和欧洲注册。
对于一个法定制造商而言,MDR*10条款所规定的所有一般性义务都是适用,另外MDR*52.7条款有对I类器械这些方面的要求进行规定。
I类(非无菌/非测量)器械基于MDD指令的“自我符合声明”,2021年5月26日之后是否依然合规?
基于MDD指令提供的自我符合声明,2021年5月26日起将不能合法投放欧盟市场。
I类无菌、带测量、可重复使用手术器械,是否需提供【定期*性更新报告PSUR】文档?
此类手术器械没有PSUR的要求。
但根据Art.85的要求,I类器械需提供上市后监督报告。

Q:MDR涵盖哪些产品?
A:MDR包含了MDD及AIMDD涵盖的所有产品。新法规扩大了应用范围,覆盖一些非用途的产品,如美瞳、面部填充或、*、皮肤改善和美容等产品。具体可参阅MDR中的Annex XVI。
Q:产品分类是否有变化?
A:MDR对于产品的分类规则有一些变化,应用范围比MDD和AIMDD的范围更广。具体可参阅MDR中的Annex VIII。
Q:IIb类植入式器械的符合性评估程序是否有变化?
A:IIb类植入式器械需要有特定产品证书(product specific certificates)——具体内容可参见器械法规MDR Annex IX或Annex X 。此证书上需要显示产品的UDI。此类产品在欧盟上市前,如证书信息有变更,必须通过公告机构的审核。

器械的制造商有责任进行合格评定,建立技术文件,发布EU合格声明并在产品上粘贴CE标志。这样该产品才能够在EEA市场上交易。
制造商粘贴CE标志的步骤:
确定适用的指令和统一的标准
验证产品特定要求
确定是否需要进行立的合格评定(NB机构参与)
测试产品并检查其合格性
草拟并保留所需的技术文档
贴上CE标志并起草欧盟符合性声明(DOC)

那么进口商和分销商要做哪些事情呢?
进口商和分销商由于它们是制造商和贸易商之间的中介,因此他们必须*了解法律要求,并确保他们分销或进口的产品符合要求。
如果进口商或分销商以自己的名义销售产品,则他们将接管制造商的责任。在这种情况下,他们必须具有有关产品设计和生产的足够信息,因为在粘贴CE标志时,他们将承担法律责任。
公告机构是欧盟的组织,用于在投放市场之前评估某些产品的合格性。当需要第三方时,这些机构执行与适用法律中规定的合格评定程序有关的任务。欧盟会发布了此类机构的清单
http://sungoyuan.b2b168.com