服务专业讲解
优势执行力高
价格合理优惠
特点量身定制
周期短
项目ce-mdr
地区全国
标准一站式全包服务
售后服务包售后
Q:MDR涵盖哪些产品?
A:MDR包含了MDD及AIMDD涵盖的所有产品。新法规扩大了应用范围,覆盖一些非用途的产品,如美瞳、面部填充或、*、皮肤改善和美容等产品。具体可参阅MDR中的Annex XVI。
Q:产品分类是否有变化?
A:MDR对于产品的分类规则有一些变化,应用范围比MDD和AIMDD的范围更广。具体可参阅MDR中的Annex VIII。
Q:IIb类植入式器械的符合性评估程序是否有变化?
A:IIb类植入式器械需要有特定产品证书(product specific certificates)——具体内容可参见器械法规MDR Annex IX或Annex X 。此证书上需要显示产品的UDI。此类产品在欧盟上市前,如证书信息有变更,必须通过公告机构的审核。
Directives 指令规定了必须达到的某些结果,是指设定所有欧盟成员国必须实现的目标的立法行为。但是,每个成员国都可以自由决定如何将指令转换为法律。
Regulations 法规是具有约束力的立法行为,对所有成员国都有直接影响。
合格评定程序:
制造商只能在满足所有适用要求的情况下才能将产品投放到欧盟市场。合格评定程序是在产品可以出售之前进行的。欧盟会的主要目标是帮助确保不*或不合规的产品进入欧盟市场。

Q:MDR对动物源性器械的影响以及法规的要求?
A:Rule 18的描述中增加了使用人源细胞或组织的器械。然而,除了包括UDI、PMS、评价等附加要求外,评价使用动物源组织的产品的方式不会有变化。
Q:对于立产品包装以及多个产品的包装, UDI是否都适用?
A:如果是立包装的产品,在每个产品的包装上都需要有UDI。对于多个产品的包装,(例如,一盒手套),只要求外包装显示UDI。具体请参阅法规Article 27和 Annex VI。
Q:新的UDI要求是否与现行的美国FDA的UDI要求一致?
A:MDR与美国FDA对于UDI的要求是存在一定差异的。但是也有许多相似点。具体可参见法规Annex VI关于UDI的要求。

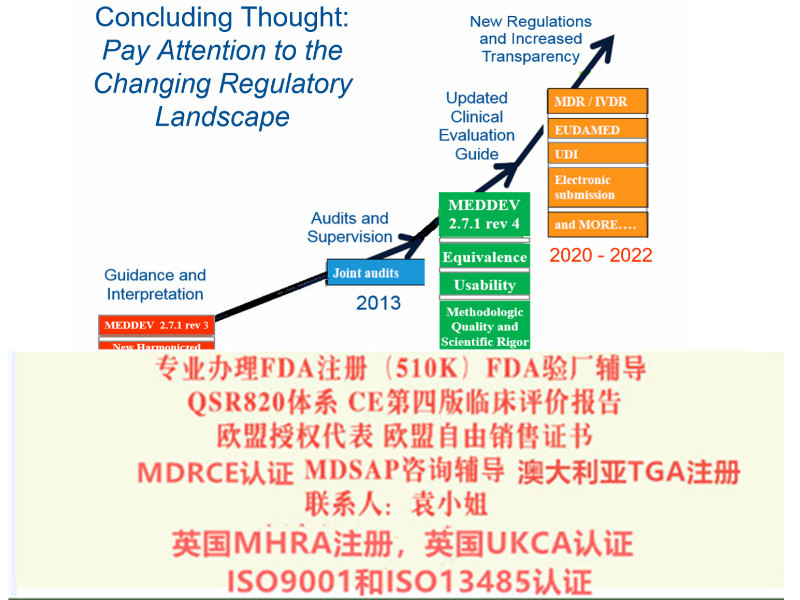
欧洲议会和理事会于2017年4月5日颁布了关于器械的新法规(EU)2017/745,并将在2020年5月26日取代之前的MDD指令和IVDD指令。 ----Regulation (EU) 2017/745 on Medical Devices
2020年4月23 日,欧盟理事会和议会对器械MDR法规进行了修订。规定将MDR法规的实施日期推迟一年,至2021年5月26日。
MDR较之MDD变化主要表现在:
强化制造商的责任:合规负责人/持续更新技术文件/财务**。
更严格的上市前评审:部分产品的分类变高/加强对证据的要求/对特定高风险器械将采用上市前审查机制,由欧盟级别的组参与,进行更严格的事先评估。
适用范围扩大:非用途,但其功能和风险特征与器械相似的器械将同样纳入MDR 的管理范围。
提高透明度和可追溯性:使用器械标识(UDI)系统识别和械/患者将收到具有所有基本信息的植入卡/将建 立包含器械认证信息和研究、警戒和上市后监测信息的修订后的可公开访问的EUDAMED 数据库。
http://sungoyuan.b2b168.com









