周期4周
费用SUNGO
品牌SUNGO
欧代荷兰
注册CIBG注册
级医用防护服、隔离衣、手术衣,欧盟授权代表,签署《欧代协议》;
SUNGO提醒我们的客户在申请产品CE认证时,在过渡阶段请谨慎考虑是选用法规还是采用老的指令方案,同时也需要对NB机构的发证进行了解和确认以保证产品在欧盟市场销售的可延续性。

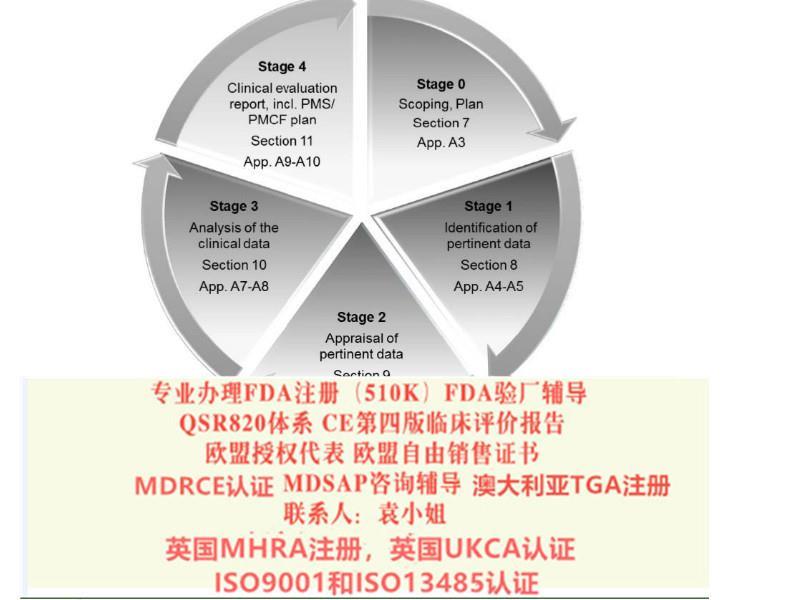
申请欧盟CE认证(CE整套技术文件编订、 CE*四版评价(MEDDEV 2.7.1 Rev 4)编写)、ISO13485:2016认证、欧盟授权代表(德国,英国和荷兰)、欧盟注册、欧盟自由销售证书
CE标志有何重要意义
CE标志的意义在于:用CE缩略词为符号表示加贴CE标志的产品符合有关欧洲指令规定的主要要求(Essential Requirements),并用以证实该产品已通过了相应的合格评定程序和/或制造商的合格声明,真正成为产品被允许进入欧共体市场销售的通行证。有关指令要求加贴CE标志的工业产品,没有CE标志的,不得上市销售,已加贴CE标志进入市场的产品,发现不符合要求的,要责令从市场收回,持续违反指令有关CE标志规定的,将被限制或禁止进入欧盟市场或退出市场。
CE是欧盟强制性的要求,所有销往欧盟市场的产品都必须标示“CE”,当然对作为救死扶伤的器械这一用具而言也不例外。在欧洲,除了主管当局如工商检查者将检查上市的器械是否带有CE标志,海关也将仅允许带有CE标志的产品通过边境。另外,器械的使用者(、)在购买新器械时也会检查是否带有CE标志。显然,CE标志可作为器械在欧盟内的“通行证”。同时,一个器械产品如果合法加贴了CE标志,也表明:
1、 该器械符合了欧盟器械法规的基本要求;
2、 该器械可以在欧盟市场内自由流通、销售及使用;
3、 该器械的整个形成过程已通过了一个相应的符合性评价程序。
欧盟器械CE指令
在器械领域,欧盟会制定发布了三个欧盟指令,以替代原来各成员的认可体系,使有关这类产品投放市场的规定协调一致。 这三个指令分别是:
1.基础器械指令(MDD,93/42/EEC),适用范围很广,包括除有源植入性和体外诊断器械之外的几乎所有的器械,如无源性器械(敷料、一次性使用产品、接触镜、、导管等);以及有源性器械,如核磁共振仪、超声诊断和仪、输液泵等。该指令已于1995年1月1日生效,过渡截止日期为1998年6月13日,从1998年6月14日起强制执行。
2.体外诊断器械指令(IVDD,98/79/EC),适用于血细胞计数器,血糖仪、检测试纸、诊断、优生诊断等体外诊断用器械产品。
3.有源植入性器械指令(AIMDD, 90/335/EEC),适用于心脏起搏器,可植入的泵等有源植入性器械。AIMD于1993年1月1日生效。过渡截止期为1994年12月31日,从1995年1月1日强制实施。
上述指令规定,在指令正式实施后,只有带有CE标志的器械产品才能在欧盟市场上销售。
The EU Medical Devices Regulation (MDR 2017/745)CE认证和CE技术文件

申请出口:美国FDA注册(含FDA510K申请)、 FDA QSR820验厂及整改、FDA警告信应对&RED LIST REMOVAL/QSR820体系/OTC验厂及整改、CE认证(CE整套技术文件编订、 CE*四版评价(MEDDEV 2.7.1 Rev 4)编写)、ISO13485:2016、欧盟授权代表、欧盟自由销售证书、英国BRC认证咨询,BSCI验厂;口罩NELNSON(尼尔森)检测:(EN 14683检测、BFE检测,VFE检测、PFE检测)、手术衣EN13795测试、防护服type5/6 (PPE认证咨询(89/686/EC个人防护指令)。
所有客户均有专属服务人员,针对市场准入过程中的问题提供的支持和解答。选择SUNGO,不是选择了一次性的合作伙伴,而是选择了一个长期的技术支持的战略伙伴。
http://sungoyuan.b2b168.com









