增高器2017/745认证介绍 2017/745/EU的CE认证升级指南 MDR 2017/745医疗器械法规
更新时间:2025-02-21 浏览数:16
所属行业:
咨询 管理咨询
发货地址:上海市金山区
产品数量:9999.00个
价格:面议
周期4周
费用SUNGO
品牌SUNGO
欧代荷兰
注册CIBG注册
MDR下的欧代相比于MDD下的欧代,要求更加严格,责任也更大。除了负有以上义务之外,还会与制造商一样为缺陷器械承担连带的法律责任。另外,授权代表应至少有一名可且持续听其调遣的负责法规符合性的人员,其在欧盟境内的器械要求方面拥有必要的知识。必要的知识应表现为以下任一一种
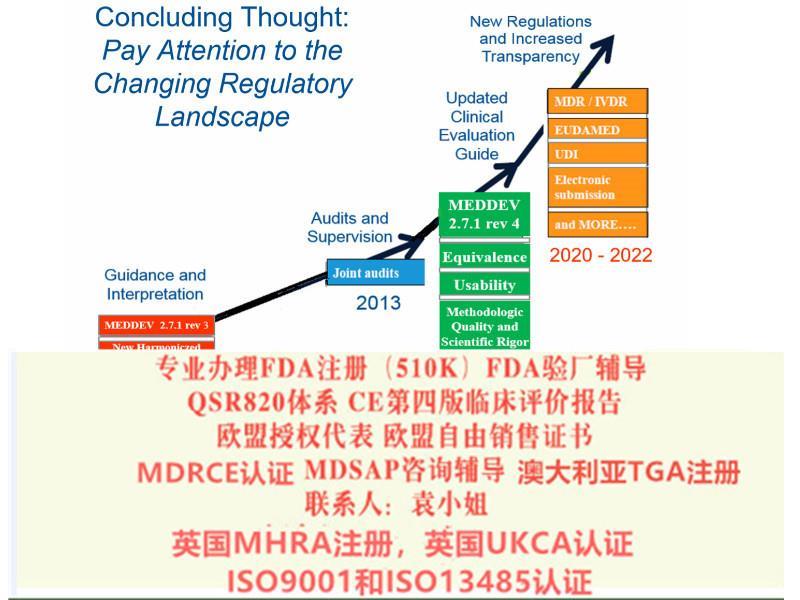
给大家带来解读MDR系列讨论 部分:演变过程和MDR的过渡期。众所周知,现行的MDD 器械指令93/42/EEC是1993颁布的,距今已经有26年的历史,这期间,器械行业无论是从技术方面,应用方面都有了巨大的变革,无疑,一部用了26年的指令已经过于陈旧,新法规替代老法规已经势在必行。2010年发生的法国PIP事件也促使了欧盟推行欧盟新法规的起草和推行。

申请欧盟CE认证(CE整套技术文件编订、 CE*四版评价(MEDDEV 2.7.1 Rev 4)编写)、ISO13485:2016认证、欧盟授权代表(德国,英国和荷兰)、欧盟注册、欧盟自由销售证书

主管当局严格NB对技术文档, 特别是评估的评审1) 强化符合性评审程序, 试验和评估, 警戒系统和市场监督系统, 确保器械的透明和可追溯性2) MDD + AIMD →MDR; IVDD →IVDR3) 药品, 化妆品和食品不在MDR/IVDR的范围内4) MDR包括含有无活性的人组织或细胞的器械5) 无用途, 但功能和风险与器械类似的产品也纳入MDR6) 含纳米材料的器械要进严格的评估定义: Commission Recommendation 2011/696/EU (OJ L 275, 20.10.2011, p.38).7) 电子商务服务 Information Society Service要符合Directive (EU) 2015/15358) 通用规范CS (Common Specification)9) 规定经销链相关方 (Economic Operator) 的职责10) MDD/AIMD中的Annex 的评估 或警戒系统纳入到了MDR的正文里11) 机构内部使用的器械12) 缺陷产品对患者的补偿13) 风险管理和评估互相依赖, 定期更新14) 法规负责人需要满足要求, 负责监督和和控制器械的生产, PMS和警戒系统的活动.

上市后跟踪的规定,要求制造商主动收集和评估上市后数据,旨在确认器械的有效性、识别之前未知的并已识别的和禁忌症、识别并分析突发风险、确有收益/ 风险的可接受性以及确定器械可能的操作不当或**标示使用以验证其预期用途是否正确。上市后跟踪在产品生命周期中的作用不可忽视。
SUNGO致力于为**的器械生产商和经营者提供市场准入的合规咨询以及国际注册服务。从产品生产、检测、过程管理、注册、认证、整改、上市跟踪等各环节为企业提供的技术支持,为产品合规和顺利上市保驾**。
http://sungoyuan.b2b168.com