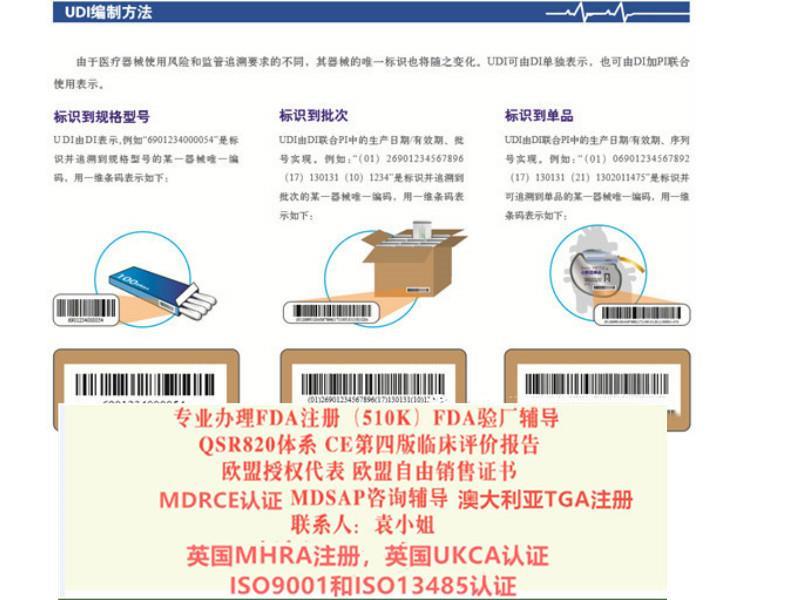
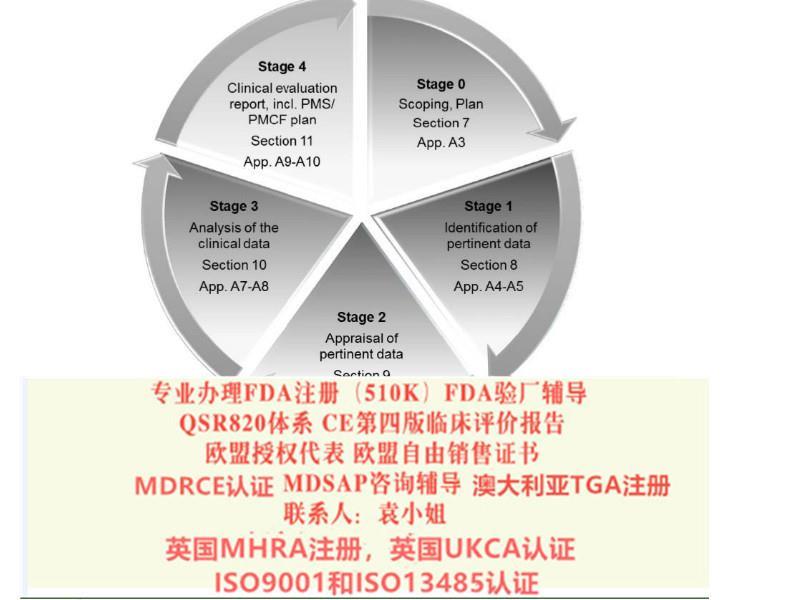
归属地上海
服务内容认证咨询
提供专属一对一客服
具体价格来电面议
认证区域**
服务优势专业细致的讲解与服务
认证价格面议
周期3-4周
内容FDA510k
近期,SUNGO的多家电动轮椅、电动代步车和手动轮椅产品获批510K,其中包括国内上市公司的产品。
短的审批时间从受理到K号审批仅58天,这些器械的连续获批,彰显了SUNGO在行动支持类器械申报510K方面的丰富经验和实力。
手动轮椅,电动轮椅或电动代步车产品,进入美国市场需要申报510K。这类产品的申报比较复杂,企业在寻求咨询机构时,考察其是否具备同类产品申报成功经验很关键。
我公司申请欧盟,美国,澳大利亚以及中东南美等等国家各类认证:FDA510K认证,欧盟自由销售证书,欧盟授权代表,ISO13485/ISO9001认证,欧盟CE认证(MDR(REGULATION (EU) 2019/745)),FDA注册,FDA验厂,英国授权代表,MHRA注册,美国代理人服务,澳大利亚TGA认证,CE整套技术文件编订、 CE*四版评价(MEDDEV 2.7.1 Rev 4)编写)、防护服PPE指令Type5/6认证、器械单一体系审核MDSAP认证、BSCI验厂、BRC 认证,澳大利亚TGA注册、口罩NELNSON(尼尔森)检测:(EN 14683检测、BFE检测,VFE检测、PFE检测)、手术衣EN13795测试,器械产品备案登记表、器械产品注册证、生产备案登记表、生产许可证
PMN,即510(k)
如上所述,对于绝大多数II类器械和少部分I类、少部分III类器械,FDA的上市前许可程序为PMN,即510(k)。
1.510(K)也即FDA的PMN要求,因其描述在FD&C Act*510(k)中,故通常称510(K)。
2.与欧盟、加拿大、澳大利亚等国家和地区所不同的是,FDA并不是要求制造商通过证实产品符合基本要求的方式来其*性和有效性,而是要求制造商证实其申请上市的产品与已上市的同类产品具有实质等同性。
3.510(K)文件(详见FDA,或向我司咨询)

我公司申请欧盟,美国,澳大利亚以及中东南美等等国家各类认证:FDA510K认证,欧盟自由销售证书,欧盟授权代表,ISO13485/ISO9001认证,欧盟CE认证(MDR(REGULATION (EU) 2019/745)),FDA注册,FDA验厂,英国授权代表,MHRA注册,美国代理人服务,澳大利亚TGA认证,CE整套技术文件编订、 CE*四版评价(MEDDEV 2.7.1 Rev 4)编写)、防护服PPE指令Type5/6认证、器械单一体系审核MDSAP认证、BSCI验厂、BRC 认证,澳大利亚TGA注册、口罩NELNSON(尼尔森)检测:(EN 14683检测、BFE检测,VFE检测、PFE检测)、手术衣EN13795测试,器械产品备案登记表、器械产品注册证、生产备案登记表、生产许可证
SUNGO依托的技术服务团队、的战略合作资源,为国内外企业完成FDA申请方案,测试及报告,完成510k申请文件的编写及提交。另外,SUNGO还可协助企业建立QSR 820质量管理体系,模拟美国FDA工厂审核,陪同美国FDA工厂审核全过程,提供美国FDA授权代理人服务。SUNGO在美国FDA认证各个环节能均能提供完整服务,并与美国FDA官员保持良好的沟通,为企业排忧解难!
大多数在美国进行商业分销的器械都是通过上市前通知书[510(k)]的形式得到批准的

我公司申请欧盟,美国,澳大利亚以及中东南美等等国家各类认证:FDA510K认证,欧盟自由销售证书,欧盟授权代表,ISO13485/ISO9001认证,欧盟CE认证(MDR(REGULATION (EU) 2019/745)),FDA注册,FDA验厂,英国授权代表,MHRA注册,美国代理人服务,澳大利亚TGA认证,CE整套技术文件编订、 CE*四版评价(MEDDEV 2.7.1 Rev 4)编写)、防护服PPE指令Type5/6认证、器械单一体系审核MDSAP认证、BSCI验厂、BRC 认证,澳大利亚TGA注册、口罩NELNSON(尼尔森)检测:(EN 14683检测、BFE检测,VFE检测、PFE检测)、手术衣EN13795测试,器械产品备案登记表、器械产品注册证、生产备案登记表、生产许可证
器械FDA认证技巧
对于I类豁免510K的器械,一般没什么技巧,我这里所说的技巧主要是针对要做510K的产品,如果运用的好,可以省不少钱呢,毕竟这都是我们这几年做FDA认证的经验精华。有时候花钱都不一定能买到这样的经验:
有些企业在申请510K时,往往恨不得把自己厂里所有的产品型号都申请上去,这是不可取的,因为FDA对产品的结构特别看重,比如上半年我们接手了一个韩国客人的裂隙灯显微镜申请FDA510K的案子,当时客人有5个型号想一次性申报上去,后来我们看了他的产品说明和技术图纸资料,大吃一惊,因为这5个型号要分成4个系列,就意味着要做4份510K报告,总费用少要50多万。后来我们建议他先做一个系列的,2个型号,等做好了以后,我们教他把其他型号的产品当做是原型号的基础上改动后的型号,这样,FDA也不会说什么。因为FDA允许企业在原型号的基础上改动产品的部分结构。这就是我们钻的空子。为企业省了不少钱呢。具体怎么做,我就不在这里细述。
http://sungoyuan.b2b168.com