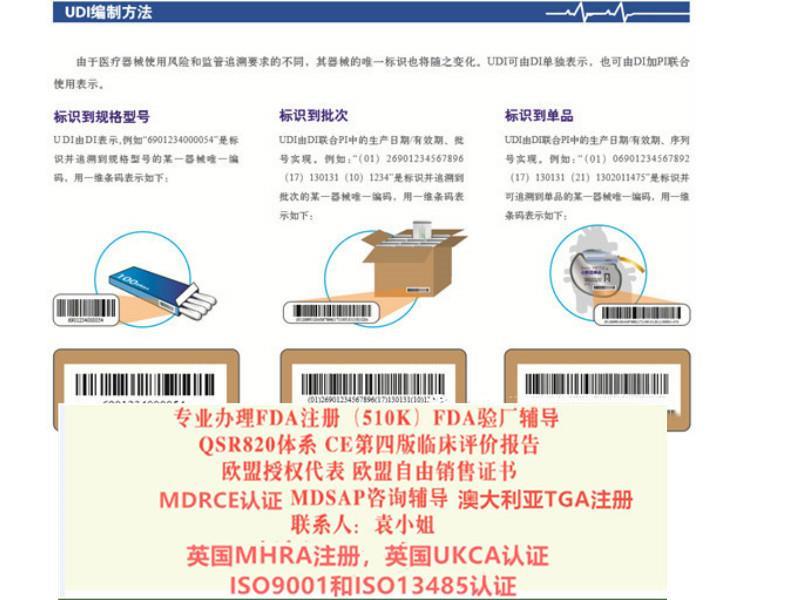
归属地上海
服务内容认证咨询
提供专属一对一客服
具体价格来电面议
认证区域**
服务优势专业细致的讲解与服务
认证价格面议
周期3-4周
内容FDA510k
基于器械检测的以上痛点,沙格实验室利用多年跟踪积累的器械注册、检验的标准,为企业提品一整套检测方案。
特别是沙格实验室提供预检服务,不仅为客户节省成本,同时还能协助企业快速完成检测,加快上市进程,抢占市场。如您所需,请联系我们!
我公司申请欧盟,美国,澳大利亚以及中东南美等等国家各类认证:FDA510K认证,欧盟自由销售证书,欧盟授权代表,ISO13485/ISO9001认证,欧盟CE认证(MDR(REGULATION (EU) 2019/745)),FDA注册,FDA验厂,英国授权代表,MHRA注册,美国代理人服务,澳大利亚TGA认证,CE整套技术文件编订、 CE*四版评价(MEDDEV 2.7.1 Rev 4)编写)、防护服PPE指令Type5/6认证、器械单一体系审核MDSAP认证、BSCI验厂、BRC 认证,澳大利亚TGA注册、口罩NELNSON(尼尔森)检测:(EN 14683检测、BFE检测,VFE检测、PFE检测)、手术衣EN13795测试,器械产品备案登记表、器械产品注册证、生产备案登记表、生产许可证
美国食品和药物管理局( FDA )简介:
FDA 是食品药品监督管理局( Food and Drug Administration )的简称。FDA通常代表也代表美国 FDA ,即美国食品药品监督管理局,美国 FDA 是国际审核机构,由美国国会即联邦授权,从事食品与药品管理的高执法机关;是一个由、律师、微生物学家、药理学家、化学家和统计学家等人士组成的致力于保护、促进和提高国民健康的卫生管制的机构。**其他许多国家也会通过寻求和接收FDA的帮助来促进并其本国产品的*。
美国FDA是美国在健康与人类服务部(DHHS)下属的公共(PHS)中设立的执行机构之一。隶属于美国卫生教育福利部,负责全国药品、食品、生物制品、化妆品、兽药、
器械以及诊断用品等的管理。总部设在华盛顿特区及马 利兰州罗克威尔城,机构
庞大,分支机构遍布全国各地。FDA主要分测试和注册两个内容,器械化妆品食品药品类产品需要进行 FDA 注册, FDA 注册可以直接在FDA上进行申请。

我公司申请欧盟,美国,澳大利亚以及中东南美等等国家各类认证:FDA510K认证,欧盟自由销售证书,欧盟授权代表,ISO13485/ISO9001认证,欧盟CE认证(MDR(REGULATION (EU) 2019/745)),FDA注册,FDA验厂,英国授权代表,MHRA注册,美国代理人服务,澳大利亚TGA认证,CE整套技术文件编订、 CE*四版评价(MEDDEV 2.7.1 Rev 4)编写)、防护服PPE指令Type5/6认证、器械单一体系审核MDSAP认证、BSCI验厂、BRC 认证,澳大利亚TGA注册、口罩NELNSON(尼尔森)检测:(EN 14683检测、BFE检测,VFE检测、PFE检测)、手术衣EN13795测试,器械产品备案登记表、器械产品注册证、生产备案登记表、生产许可证
器械FDA 510(k)注册,因其相应FD&C Act*510,故通常称510(K)注册。FDA 510(k)为器械在美国上市的主要途径之一,绝大多数的II类器械和部分I类、III类器械通过此途径清关上市。对FDA 510(k)注册文件所必须包含的信息,FDA有一个基本的要求,其内容大致如下16个方面:
1) 申请函,此部分应包括申请人(或联系人)和企业的基本信息、FDA 510(K)递交的目的、申请上市器械的名称型号和分类资料、进行实质等效比较的产品(Predicate Device)名称及其510(k)号码;
2) 目录,即FDA 510(k)文件中所含全部资料的清单(包括附件);
3) 真实性保证声明,对此声明,FDA有一个标准的样本;
4) 器材名称,即产品通用名、FDA分类名、产品贸易名;
5) 注册号码,如企业在递交FDA 510(k)时已进行企业注册,则应给出注册信息,若未注册,也予;
6) 分类,即产品的分类组、类别、管理号和产品代码;
7) 性能标准,产品所满足的强制性标准或自愿性标准;
8) 产品标识,包括企业包装标识、使用说明书、包装附件、产品标示等;
9) 实质相等性比较(SE);
10)510(k)摘要或声明;
11) 产品描述,包括产品的预期用途、工作原理、动力来源、零组件、照片、工艺图、装配图、结构示意图等;
12) 产品的*性与有效性,包括各种设计、测试资料;
13) 生物相容性;
14) 色素添加剂(如适用);
15) 软件验证(如适用);
16) 灭菌(如适用),包括灭菌方法的描述、灭菌验证产品包装和标识等。

我公司申请欧盟,美国,澳大利亚以及中东南美等等国家各类认证:FDA510K认证,欧盟自由销售证书,欧盟授权代表,ISO13485/ISO9001认证,欧盟CE认证(MDR(REGULATION (EU) 2019/745)),FDA注册,FDA验厂,英国授权代表,MHRA注册,美国代理人服务,澳大利亚TGA认证,CE整套技术文件编订、 CE*四版评价(MEDDEV 2.7.1 Rev 4)编写)、防护服PPE指令Type5/6认证、器械单一体系审核MDSAP认证、BSCI验厂、BRC 认证,澳大利亚TGA注册、口罩NELNSON(尼尔森)检测:(EN 14683检测、BFE检测,VFE检测、PFE检测)、手术衣EN13795测试,器械产品备案登记表、器械产品注册证、生产备案登记表、生产许可证
何时*510(k)
下面情况下* 510(k):
如果器械厂家向另一个企业卖没有完工的器械,要求进一步加工,其中包括用于其它企业组装器械的零件的情况下,不需要递交510(k)。 然而,如果生产的零件是要直接卖给终端用户作为替代零件,就需要510(k)。
如果生产的器械不上市或不进行商业分发,就不需要 510(k)评估或检验器械。这包括评估。如果生产的器械用于进行试验,则可能受到研究用器械赦免(IDE)法规的管理。
如果分销其他公司国内生产的器械,代理商不需要递交510(k)。代理商可以把“Distributed by ABC Firm”的标签贴在器械上,卖给终端用户而不用递交510(k)。
大多数情况下,如果器械现有的标签或条件没有显著改变,那么再包装者或再标注者就不要求递交510(k)。
如果器械是在1976年5月28日之前合法上市的,就不用递交510(k)文件,除非进行了改进或使用目的上有变化。这些器械被称为“grandfathered”。
如果是外国制造器械的进口商,在下列情况下不需要递交510(k):
510(k)已经由外国厂家递交,并得到上市批准,或
510(k) 已经由进口商代表外国厂商递交了,并得到上市批准。如果一个进口商代表外国厂商递交了510(k),那么所有从相同的国外厂商(510(k)持有人)进口相同器械的其他进口商就不要求递交此器械的510(k)文件。
某些Ⅰ类或Ⅱ类器械在次上市时可以不递交510(k)。Ⅰ类和Ⅱ类赦免器械的规范可以在器械赦免中找到。
SUNGO将协助您完成510(k)的整个申请,并让您的产品终获得美国FDA的批准,获得进入美国市场的入场券。
我公司申请欧盟,美国,澳大利亚以及中东南美等等国家各类认证:FDA510K认证,欧盟自由销售证书,欧盟授权代表,ISO13485/ISO9001认证,欧盟CE认证(MDR(REGULATION (EU) 2019/745)),FDA注册,FDA验厂,英国授权代表,MHRA注册,美国代理人服务,澳大利亚TGA认证,CE整套技术文件编订、 CE*四版评价(MEDDEV 2.7.1 Rev 4)编写)、防护服PPE指令Type5/6认证、器械单一体系审核MDSAP认证、BSCI验厂、BRC 认证,澳大利亚TGA注册、口罩NELNSON(尼尔森)检测:(EN 14683检测、BFE检测,VFE检测、PFE检测)、手术衣EN13795测试,器械产品备案登记表、器械产品注册证、生产备案登记表、生产许可证
对于I类豁免510K的器械,做FDA注册相对比较简单,只要提供申请人信息(包括公司名称、地址、电话、联系人、邮箱、等)和产品英文名称即可,要是能多提供一些产品信息自然更好.
对于II类器械,要提供的资料就非常的多,比如:产品标识,包括企业包装标识、使用说明书、包装附件、产品标示、产品描述,包括产品的预期用途、工作原理、动力来源、零组件、照片、工艺图、装配图、结构示意图、标准规范、测试报告、软件验证资料等,这些都是*的
http://sungoyuan.b2b168.com