腕式血压计fda认证510k 医疗器械fda认证510k标准
更新时间:2025-04-13 浏览数:19
所属行业:
咨询 管理咨询
发货地址:上海市金山区
产品数量:9999.00套
价格:面议
归属地上海
服务内容认证咨询
提供专属一对一客服
具体价格来电面议
认证区域**
服务优势专业细致的讲解与服务
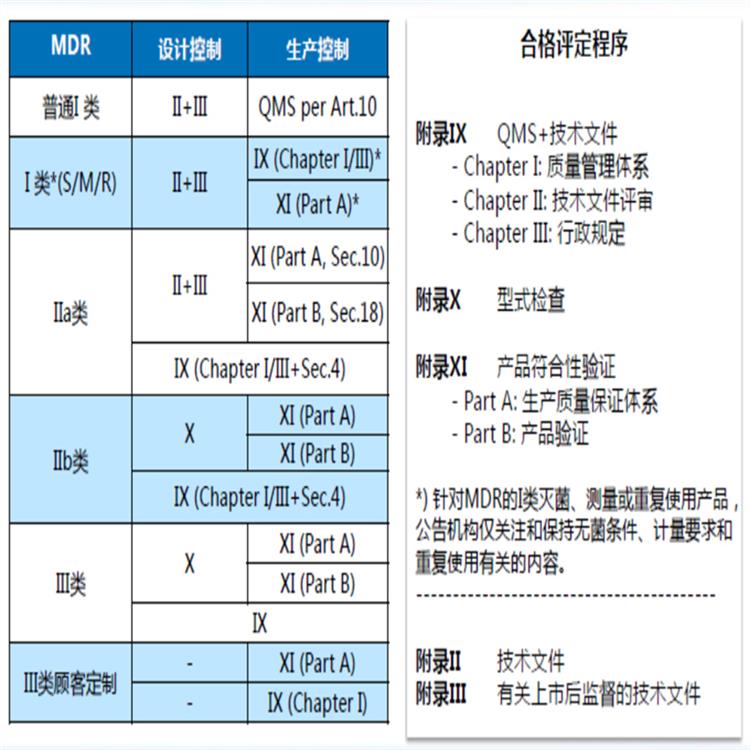
出口欧盟:在欧盟市场“CE”标志属强制性认证标志,不论是欧盟内部企业生产的产品,还是其他生产的产品,要想在欧盟市场上自由流通,必须加贴“CE”标志,以表明产品符合欧盟《技术协调与标准化新方法》指令的基本要求。这是欧盟法律对产品提出的一种强制性要求。
哪些情况需要申请510(K)
除非获得豁免,否则将设备引入商业分销(营销),想要在美国销售设备的人都必须在提供该设备进行销售的至少90天前提交510(k)呈交,即使该日期之前可能已经在开发或研究中。
对合法销售的设备进行了更改或修改,并且该更改可能会严重影响其*性或有效性。510(k)持有人有责任决定修改是否会严重影响设备的*性或有效性。必须根据质量体系法规21 CFR 820进行修改,并记录在设备主记录和变更控制记录中。
对于现有设备的更改或修改,需要提交新的510(k)提交文件,其中修改可能会严重影响设备的*性或有效性,或者要将该设备销售用于新的或不同的预期用途。
510(K)收费
分两部分:
1.美国国会已授权FDA收取器械企业的年度企业注册费(场所注册年费)。也就是说,在FDA注册的器械企业均需给FDA支付费用,并且每年都要支付。2021年度的财政收费为:5546美金。
2.产品评审费,2021年度评审费为:12432美金。若企业符合小规模资质,可减免至3108美金。

除了美国和欧洲,沙格还可以为您提供其他的出口注册认证。
沙格为您提供:
1)加拿大:加拿大注册
2)MDSAP单一体系审核方案
3)MDSAP 是一种可以对器械制造商进行一次审核以符合多达五个不同器械市场的标准和要求的方式:澳大利亚、巴西、加拿大、日本和美国。

为什么要申请510(K)
510(k) 是向 FDA 提出的上市前申请文件,目的是申请 510(k) 的器材不需进行上市前核准 (PMA) 且与已合法上市之一种或多种相似产品具相同*性及有效性,此即实质相等性 (substantially equivalent)。

申请流程
1)依据客户的产品信息,确定产品的代码;
2)确定比对器械,需要和申请的产品类似;
3)依据FDA公布信息确定产品测试标准,实验室,协助客户确定相关的检测方法,样品制备,检测费用等;
4)进行信息修订并编制510(k)文件
5)提交文件给FDA后,进行验收审查
6)进行实质审查
7)获得Clearance Letter
SUNGO致力于为**的器械生产商和经营者提供市场准入的合规咨询以及国际注册服务。从产品生产、检测、过程管理、注册、认证、整改、上市跟踪等各环节为企业提供的技术支持,为产品合规和顺利上市保驾**。十多年里,SUNGO已为**30多家上市公司和**器械制造商,合计5000多家企业提供过相关服务。
http://sungoyuan.b2b168.com