医疗的EU 2017/745认证的要求 需要什么资料
更新时间:2025-05-31 浏览数:13
所属行业:
咨询 管理咨询
发货地址:上海市金山区
产品数量:9999.00个
价格:面议
归属地上海
服务内容认证咨询
提供专属一对一客服
具体价格来电面议
认证区域**
服务优势专业细致的讲解与服务
认证价格面议
周期3-4周
内容FDA510k
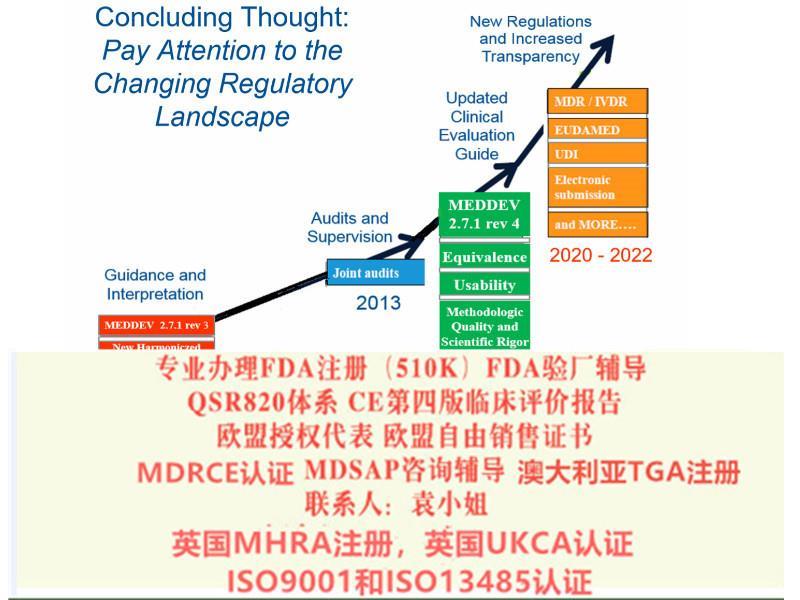
在欧盟将轮椅车推向市场之前,必须符合欧盟法规(EU)2017/745中的必要要求。该法规涵盖了各种各样的产品,根据附录Ⅷ中的分类规则,轮椅车和代步车均被归类为Ⅰ类。
如果成品器械厂家根据他们自己的规范装配器械,并在美国上市,那么必须递交510(k)

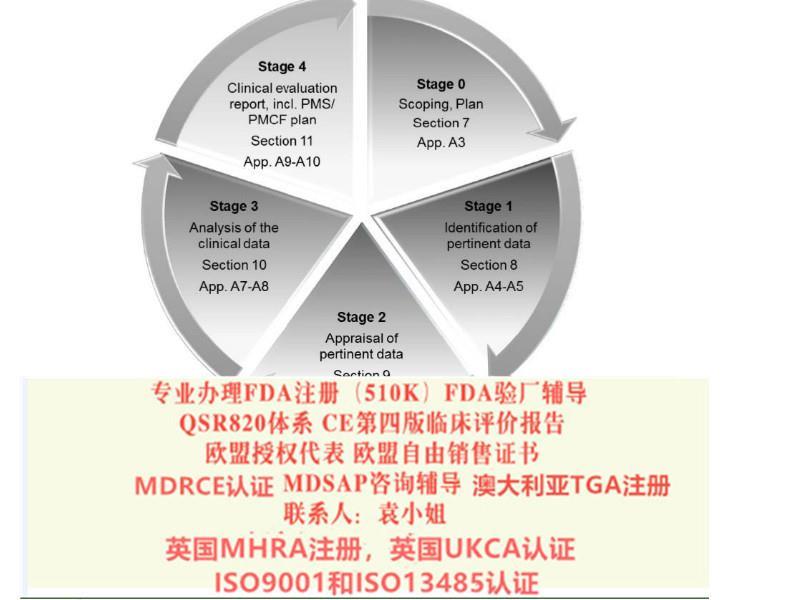
我公司申请欧盟,美国,澳大利亚以及中东南美等等国家各类认证:FDA510K认证,欧盟自由销售证书,欧盟授权代表,ISO13485/ISO9001认证,欧盟CE认证(MDR(REGULATION (EU) 2019/745)),FDA注册,FDA验厂,英国授权代表,MHRA注册,美国代理人服务,澳大利亚TGA认证,CE整套技术文件编订、 CE*四版评价(MEDDEV 2.7.1 Rev 4)编写)、防护服PPE指令Type5/6认证、器械单一体系审核MDSAP认证、BSCI验厂、BRC 认证,澳大利亚TGA注册、口罩NELNSON(尼尔森)检测:(EN 14683检测、BFE检测,VFE检测、PFE检测)、手术衣EN13795测试,器械产品备案登记表、器械产品注册证、生产备案登记表、生产许可证
服务流程:
1:确定产品的分科及风险级别;
2:确定产品适用的公认标准及FDA推荐的指南文件;
3:确定等价器械;
4:拟定技术资料清单,说明技术资料的详细要求
5:分三个环节,必要时可以同步进行
①、技术资料准备
②、产品测试;
6:审查检测报告、资料、编写510(k)文件、申请邓氏码;
7:用户提交510(k)评审费、提交510(k)文件;
8:跟踪510(k)文件评审进度;
9:补充、修改510(k)文件;
10:获得FDA批准函,用户提交企业注册费,进行企业注册与产品列品。

美国FDA注册(含FDA510K申请)、美国代理人Us Agent、FDA 验厂及整改
任何想在美国出售器械的人都要求在器械上市之前至少90天递交510(k)申请
http://sungoyuan.b2b168.com