如何办理MDR EU 2017/745 MDR认证 在线免费报价-需要什么材料
更新时间:2025-09-24 浏览数:104
所属行业:
咨询 管理咨询
发货地址:上海市浦东新区陆家嘴街道
产品数量:9999.00个
价格:¥9.00 元/个 起
在DoA之后,现有指令下的公告机构颁发的证书是否仍然有效?
是的,AIMDD / MDD证书通常在的到期日之前有效。 这适用于通知机构通常颁发的所有证书,包括EC设计检验证书,合格证书,EC型式检验证书,EC证书*质量保证体系和EC证书生产质量保证。
但是,所有在2017年5月25日之后签发的证书迟在2024年5月27日之前无效。在此日期之后,将不再有效的AIMDD / MDD证书。
是否可以在2024年5月27日之前同时获得有效的MDR和AIMDD / MDD证书?
是。
在过渡期结束后,制造商是否仍然可以投放市场/投入使用符合指令的设备?
是的,在某些条件下,可以选择继续投放市场/投入使用符合指令的设备,直到其现有证书到期为止。 这可以避免在MDR下立即需要新证书。
要使用此选项,所有现有证书必须有效(例如,QMS),设备的目的和性质不得改,并且您必须遵循新的MDR规则进行注册,监视和警惕。

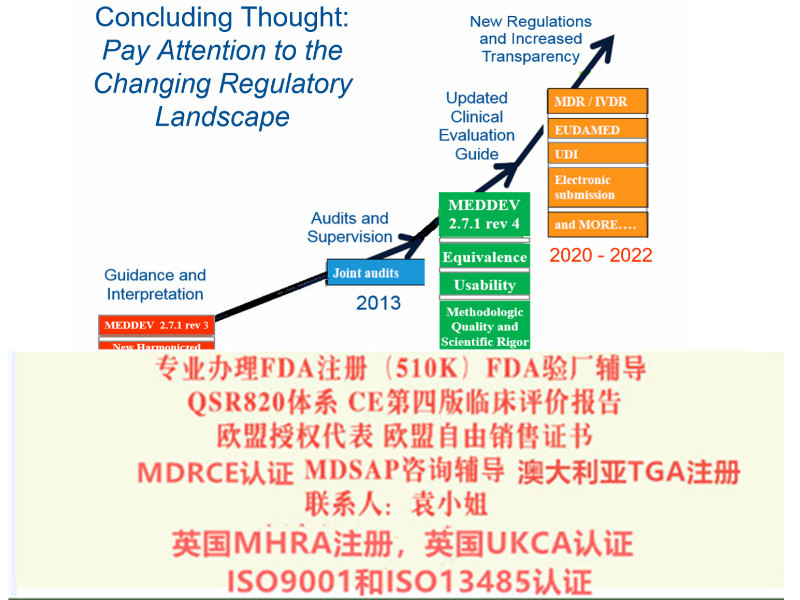
2017年5月5日,欧盟期刊(Official Journal of the European Union)正式发布了欧盟医疗器械法规(REGULATION (EU) 2017/745,简称“MDR”)。MDR将取代Directives 90/385/EEC (有源植入类医疗器械指令)and 93/42/EEC(医疗器械指令)。依据MDR Article 123的要求,MDR于2017年5月26日正式生效,并与2020年5月26日期正式取代MDD(93/42/EEC)和AIMDD(90/385/EEC)。日前公告机构BSI获得了欧盟新法规MDR(EU 2017/745)的资格授权。也意味着近期BSI、TUV南德、TUV莱茵、***等公告机构,也陆续可以开始受理MDR的申请。
MDR实施之后,在三年过渡期内仍然可以按照MDD和AIMDD申请CE证并保持证的有效性。依据Article 120 clause2 的规定,过渡期内NB签发的CE证继续有效,但是从其交付日期起有效期不**过5年,并且于2024年5月27日失效。
MDR的主要变化
1.扩大了应用范围
2.提出了新的概念和器械的定义
3.细化了医疗器械的分类
4.完善了器械的通用*和性能要求
5.加强对技术文件的要求
6.加强器械上市后的监管
7.完善临床评价相关要求
8.提出Eudamed数据库的建立和使用
9.提出器械的可追溯性(UDI)
10.对NB提出严格的要求

一,DMR的主要变化
1.扩大了应用范围
2.提出了新的概念和器械的定义
3.细化了医疗器械的分类
4.完善了器械的通用*和性能要求
5.加强对技术文件的要求
6.加强器械上市后的监管
7.完善临床评价相关要求
8.提出Eudamed数据库的建立和使用
9.提出器械的可追溯性(UDI)
10.对NB提出严格的要求
MDR简介
2017年5月5日,欧盟期刊(Official Journal of the European Union)正式发布了欧盟医疗器械法规(REGULATION (EU) 2017/745,简称“MDR”)。MDR将取代Directives 90/385/EEC (有源植入类医疗器械指令)and 93/42/EEC(医疗器械指令)。依据MDR Article 123的要求,MDR于2017年5月26日正式生效,并与2020年5月26日期正式取代MDD(93/42/EEC)和AIMDD(90/385/EEC)。
医疗器械食品化妆品法规服务
MDR实施之后,在三年过渡期内仍然可以按照MDD和AIMDD申请CE证书并保持证书的有效性。依据Article 120 clause2 的规定,过渡期内NB签发的CE证书继续有效,但是从其交付日期起有效期不**过5年,并且于2024年5月27日失效。

-/gbaaeee/-
http://sungoyuan.b2b168.com