TUV南德的CE MDR认证流程 在线免费咨询-需要什么材料
更新时间:2025-06-06 浏览数:191
所属行业:
咨询 管理咨询
发货地址:上海市浦东新区陆家嘴街道
产品数量:9999.00个
价格:¥9.00 元/个 起
临床评价
◇产品临床测试报告及相关文献
◇临床使用概述及*观点
附1、产品出厂检测报告
附2、产品型式检测报告
附3、基本要求检查表
备注:
◇临床研究(包括:物理性能,生化、药理 、药动及毒性研究,功效测试,灭菌合格证明,药物相容性等)
◇生物兼容性测试(A)部分要求:细胞毒性、感光性、刺激-皮内反应、急性全身中毒、致热性、亚急性中毒、遗传毒性、植入溶血性; (B)支持测试:慢性中毒、致癌性、再生性/生长性毒素、生物动因退化。)
◇临床资料(需要临床研究或描述临床研究)
◇包装合格证明
◇标签、使用说明
◇结论(设计档案资料的接受、利益对应风险的陈述)
10、欧盟授权代表信息及协议
11、符合基本要求表
12、协调标准
13、警戒系统程序

我们该怎么办?
l 重新确认产品风险分类等级,确认是否有风险等级升级的情况?
例如部分可重复使用的医疗器械,原属于ClassⅠ的器械,按照新法规变成了ClassⅠ类器械。美容类产品原MDD下不属于医疗范围,现MDR法规中已纳入;
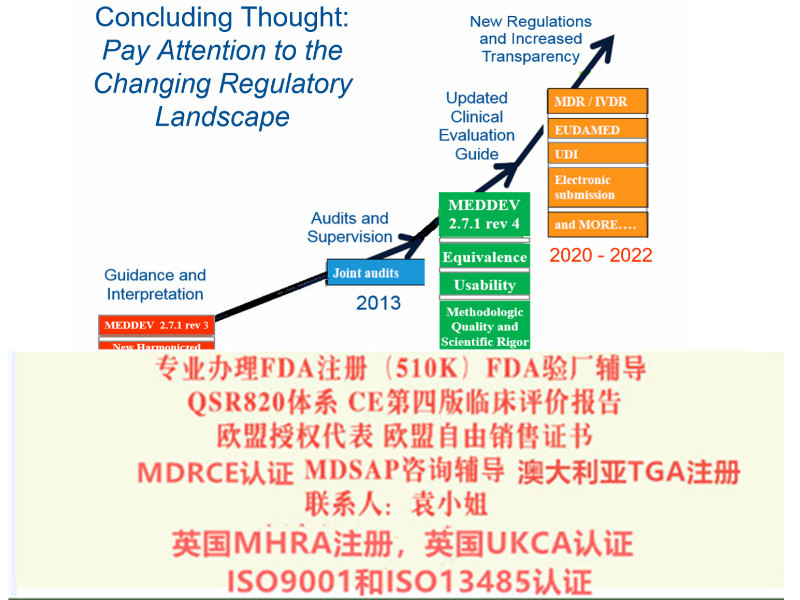
l 确认原CE证书的发证机构是否已获得欧盟当局批准的颁发MDR证书的资质,目前拥有该资质的认证机构:BSI、TUV南德(注意TUV莱茵目前还未获得批准);
l 确认原CE认证时的技术文件中是否含有按照Rev4指导原则提供的临床评价报告;
l 确定企业合规负责人(MDR法规要求),有相应能力、资质和经验来承担相应的法规工作职责。
l 修改原CE技术文件,建立质量管理体系,向具有MDR发证资质的认证机构提出MDR-CE认证申请,获得MDR法规下的新CE证书。
Q:证书未在过渡期结束前签发怎么办?
A:对于持有符合MDD或AIMDD的CE证书的制造商,将有3年的过渡期来满足MDR的要求。
在过渡期按照MDD和AIMDD签发的CE证书,在正式生效日期(2020年5月26日)后将继续有效,但有效期较多不能**过4年。而在过渡期结束后的证书有效性取决于法规Article 120 clause 3所述规定。
如果您符合MDD的CE证书在过渡期内失效,且又未在过渡期内符合MDR的CE证书。那么你的产品必须从欧盟市场退出,直到产品获得符合MDR的CE证书才可重新上市。
Q:公告机构何时开始按照MDR进行符合性评审?
A:所有公告机构需要获得欧盟主管当局的认可后,才能按照MDR进行审核。

-/gbaaeee/-
http://sungoyuan.b2b168.com









