新的医疗器械法规(2017/745 / EU)(MDR)和体外诊断医疗器械法规(2017/746 / EU)(IVDR)使欧盟立法与技术进步,医学科学变革和进步在法律上保持一致。
新法规将建立一个健全,透明,可持续的监管框架,得到认可,可提高临床*性并为制造商创造公平的市场准入。与指令不同,法规不需要转变为国家法。
医疗器械法规(MDR)的背景
MDR将取代现有的医疗器械指令(93/42/EEC)(MDD)和主动植入式医疗器械指令(90/385/EEC) (AIMDD)。MDR于2017年5月发布,标志着MDD和AIMDD之间为期三年的过渡期的开始。
在过渡期间,MDR将逐步生效,首先是与公告机构和制造商根据MDR申请新证书的能力有关的规定。

公告机构NB
根据MDR新规定,必须公告机构。医疗器械将被要求满足严格的标准,特别是在临床能力方面。公告机构可于2017年11月26日起申请。的过程可能需要12个月或长时间,包括来自不同国家和欧洲当局的评估人员。这意味着,根据新规定的首批公告机构可能在2018年底前到位。
公告机构数据库(NANDO)可在此找到。
4.合格评定
根据某些装置的危险类别和具体特征,对符合CE标志的装置的评价各不相同(五十二条)。所有IIa、IIb和III类设备以及一些特定的I类设备都需要一个通知机构的干预(见7a5、b6和c7段)。52条和附件九、十、习叙述了根据设备类别不同的评估方法。在某些情况下,制造商对合格评定路线有一些选择。
对于某些III类和IIb类设备,有一个新的临床评估咨询程序,该程序将由一个立的*组根据该公告机构的临床评估评估报告进行(五十四条)。
附件一规定了一般的*和性能要求,附件二和三规定了技术文件的组成。
质量管理体系的范围(10条9款)包括临床评价和上市后临床随访。临床评价计划必须先于临床评价本身(附件十四,A部分)。
可以为某些设备确定附加要求的通用规范(9条)。

项目背景()
欧洲议会和理事会于2017 年4 月5 日签发的关于医疗器械2017/745 号法规, 修订了2001/83/EC 号指令,178/2002 号(EU)法规和1223/2009 号(EU)法规,并废除了理事会90/385/EEC 号和93/42/EEC 号指令.
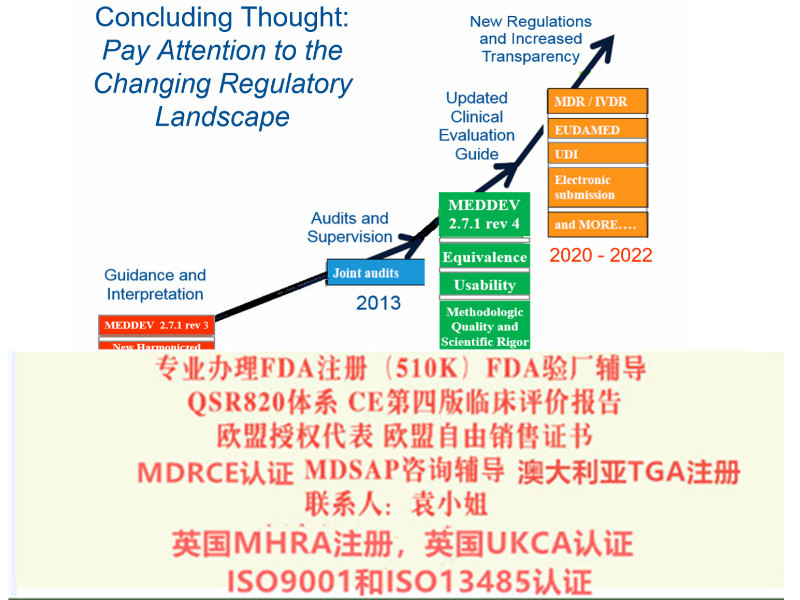
MDR实施之后,在三年过渡期内仍然可以按照MDD和AIMDD申请CE证书并保持证书的有效性。依据Article 120 clause2 的规定,过渡期内NB签发的CE证书继续有效。至2020年5月26日,MDR法规将*强制实施。至2022年5月26日IVDR法规将*强制实施。至2014年,MDD/ AIMD证书全部失效。
MDR新法规变化
1)扩大了应用范围
2)提出了新的概念和器械的定义
3)细化了医疗器械的分类
4)完善了器械的通用*和性能要求
5)加强对技术文件的要求
6)加强器械上市后的监管
7)完善临床评价相关要求
事故对于患者意味着伤害,对于企业的生存也具有巨大的破坏力。因此,临床评估的设计和临床数据的收集具有至关重要的意义。然而在实践中,许多制造商不清楚什么是欧盟法规所要求的临床评估,什么样的临床数据能满足欧盟的法规要求。
欧盟四版临床评价(MEDDEV 2.7.1 Rev 4)指南主要变化
a)临床报告新的频率
b)报告编写人和评价人的
c)评价报告需要有明确的可测量的目标
d)确定技术发展水平
e)数据的科学性和有效性
f)比对器械
g)比对器械的数据获得
h)什么时候需要临床试验
i)风险-收益
j)售后监督和售后临床跟踪
8)提出Eudamed数据库的建立和使用
9)提出器械的可追溯性(UDI)
10)对NB提出严格的要求
-/gbaaeee/-
http://sungoyuan.b2b168.com









