FDA美国代理人验证码确认 联系我们获取多资料-需要什么材料
更新时间:2025-06-10 浏览数:181
所属行业:
咨询 管理咨询
发货地址:上海市浦东新区陆家嘴街道
产品数量:9999.00个
价格:面议
美国代理人不能只是邮箱、语音电话,或者作为国外工厂代理人的个人地址根本就不存在的场所。

我们可以为您提供的自主服务项目主要有:
出口欧洲法规:欧盟CE认证(CE整套技术文件编订、 CE四版临床评价(MEDDEV 2.7.1 Rev 4)编写)、ISO13485:2016认证、欧盟授权代表(德国,英国和荷兰)、欧盟注册、欧盟自由销售证书、防护服PPE指令Type5/6认证
出口美国法规:医疗器械、化妆品、食品美国FDA注册(含FDA510K申请)、美国代理人、 FDA 验厂辅导及整改、FDA警告信应对&RED LIST REMOVAL、QSR820体系辅导、食品FDA验厂辅导及整改、OTC药品FDA验厂辅导及整改
中国法规:医疗器械产品备案登记表、医疗器械产品注册证、生产备案登记表、生产许可证、经营许可证、ISO9001/13485认证辅导、SFDA验厂辅导、SFDA注册检测、企业标准编制、药监局自由销售证。
出口其余法规:医疗器械单一体系审核MDSAP认证、澳大利亚TGA注册、BSCI验厂辅导、ISO22716 GMPC验厂辅导、BRC 认证,口罩NELNSON(尼尔森)检测:(EN 14683检测、BFE检测,VFE检测、PFE检测)、手术衣EN13795测试
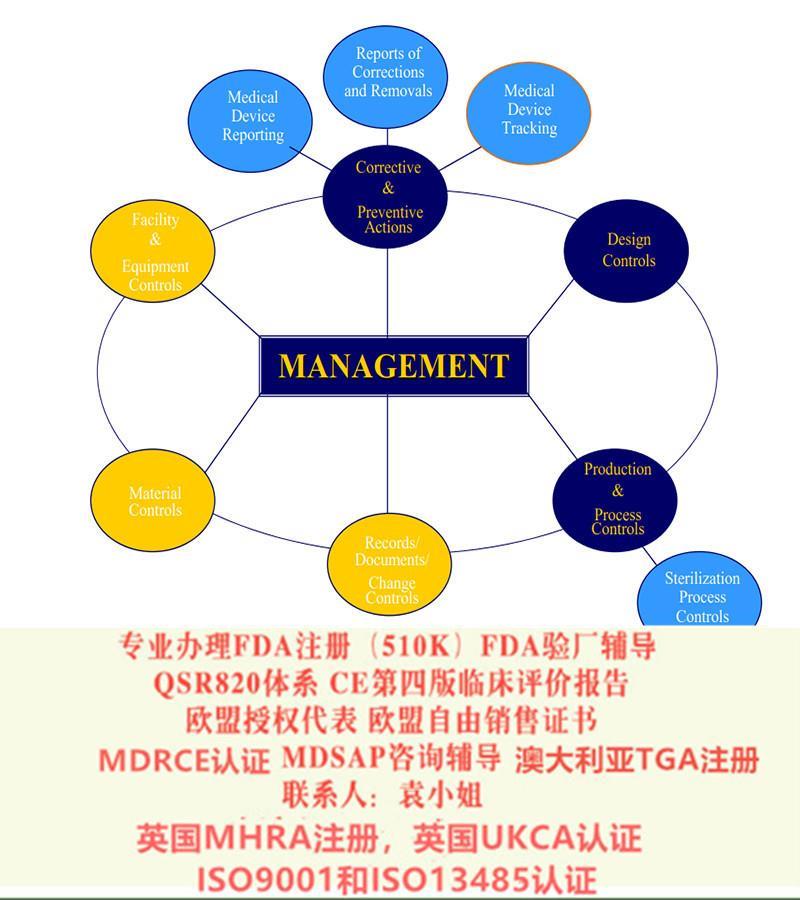
医疗器械法规—FDA注册
• I类(CLASS I)产品,绝大部分只需进行登记(LISTING)和实施GMP规范,产品即可进入美国市场。其中不少产品连GMP也豁免, 较个别产品则需向FDA递交“上市前通知” ,即510(K)。
• II 类(CLASS II)产品,在进行设施登记和器械注册后,还需实施GMP和递交“上市前通知” 即510(K) 申请。个别产品510(K)豁免。
每年新FDA 要求:
• 1) 注册和登记每年要新一次(新时间是:10月1号到12月31号
• 2) 要随时通知FDA注册和登记内容的变化。
– II 类产品,在进行设施登记和器械注册后,还需递交“上市前通知” 即510(K)申请。只有个别产品510(K) 豁免。

完成美国FDA注册的时候需要一个美国境内的代理人信息

-/gbaaeee/-
http://sungoyuan.b2b168.com