在DoA之后,现有指令下的公告机构颁发的证书是否仍然有效?
是的,AIMDD / MDD证书通常在的到期日之前有效。 这适用于通知机构通常颁发的所有证书,包括EC设计检验证书,合格证书,EC型式检验证书,EC证书*质量保证体系和EC证书生产质量保证。
但是,所有在2017年5月25日之后签发的证书迟在2024年5月27日之前无效。在此日期之后,将不再有效的AIMDD / MDD证书。
是否可以在2024年5月27日之前同时获得有效的MDR和AIMDD / MDD证书?
是。
在过渡期结束后,制造商是否仍然可以投放市场/投入使用符合指令的设备?
是的,在某些条件下,可以选择继续投放市场/投入使用符合指令的设备,直到其现有证书到期为止。 这可以避免在MDR下立即需要新证书。
要使用此选项,所有现有证书必须有效(例如,QMS),设备的目的和性质不得改,并且您必须遵循新的MDR规则进行注册,监视和警惕。

过渡期将于2020年5月26日,即MDR法规的“适用日期”(DoA)结束。从那时起,MDR将完全适用。
1.MDR适用范围
MDR的范围已经扩大了,因此作为制造商,您必须检查您的产品组合,以确定与指令相比,是否有多的设备属于法规的范围。注意附件十六所列的产品,这些产品一旦通过载列共同规格的实施细则,就会纳入本规例。不属于本范围的产品清单见6段。
2. 制造商的义务
经销商,制造商,进口商等的义务及其关系现已在该条例中明确规定。
10条制造商应有风险管理制度(2款)和质量管理制度(9款);进行临床评估(3段);编写技术文件(4段);,并采用合格评定程序(6段)。制造商亦须对其产品在市场上销售后负责(12、13、14段)。它们必须有适当的制度来弥补它们对有缺陷的装置造成的损害所负的财务责任(16段)。
每个制造商应一名负责合规的人员(15条)。
一些可植入设备的制造商必须为患者提供植入卡(18条)。
一旦制造商完成所有这些义务,他们应一份符合性声明(19条),并在其设备上应用CE标记(20条)。
欧盟/欧洲经济区以外的制造商应与欧盟/欧洲经济区内的授权代表签订合同(11条)。
授权代表(11条)、进口商(13条)和分销商(14条)的义务也作了明确说明。
项目背景()
欧洲议会和理事会于2017 年4 月5 日签发的关于医疗器械2017/745 号法规, 修订了2001/83/EC 号指令,178/2002 号(EU)法规和1223/2009 号(EU)法规,并废除了理事会90/385/EEC 号和93/42/EEC 号指令.
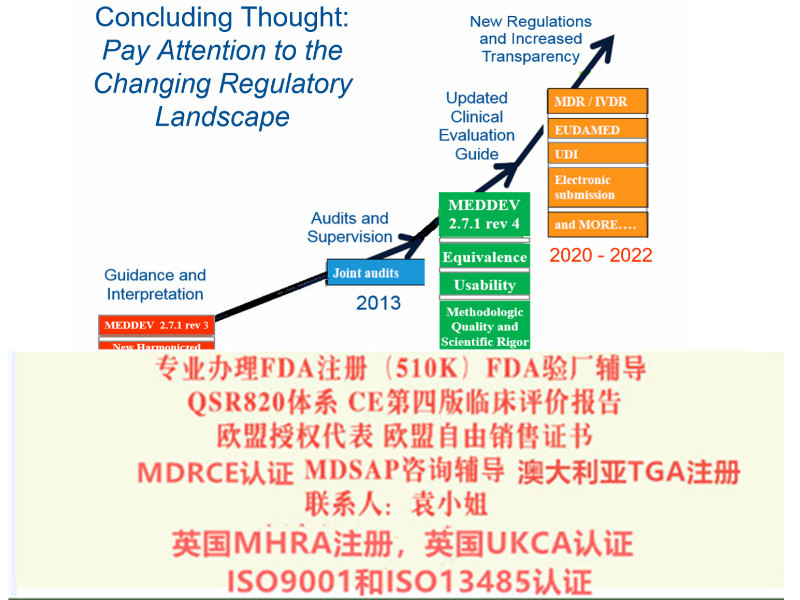
MDR实施之后,在三年过渡期内仍然可以按照MDD和AIMDD申请CE证书并保持证书的有效性。依据Article 120 clause2 的规定,过渡期内NB签发的CE证书继续有效。至2020年5月26日,MDR法规将*强制实施。至2022年5月26日IVDR法规将*强制实施。至2014年,MDD/ AIMD证书全部失效。
MDR新法规变化
1)扩大了应用范围
2)提出了新的概念和器械的定义
3)细化了医疗器械的分类
4)完善了器械的通用*和性能要求
5)加强对技术文件的要求
6)加强器械上市后的监管
7)完善临床评价相关要求
事故对于患者意味着伤害,对于企业的生存也具有巨大的破坏力。因此,临床评估的设计和临床数据的收集具有至关重要的意义。然而在实践中,许多制造商不清楚什么是欧盟法规所要求的临床评估,什么样的临床数据能满足欧盟的法规要求。
欧盟四版临床评价(MEDDEV 2.7.1 Rev 4)指南主要变化
a)临床报告新的频率
b)报告编写人和评价人的
c)评价报告需要有明确的可测量的目标
d)确定技术发展水平
e)数据的科学性和有效性
f)比对器械
g)比对器械的数据获得
h)什么时候需要临床试验
i)风险-收益
j)售后监督和售后临床跟踪
8)提出Eudamed数据库的建立和使用
9)提出器械的可追溯性(UDI)
10)对NB提出严格的要求

(EU)2017/745是指CE认证新的法规MDR,之前是MDD指令93/42/EEC
现在CE认证由MDD指令升级到MDR法规了,所以整体要求都提高了很多。
打个比方:之前考试60分就可以及格,现在要80分才能及格;之前考试考三门,现在考试考五门。
所以整个难度提升很多。
说到这里 企业应该如何面对新法规的升级呢?
按照MDR法规要求。关键的内容包括如下几个方面:
企业的质量管理体系 EN ISO13485:2016
产品的型式试验 TYPE TESTING
产品的技术文件 TECHNICAL CONSTRUCTION FILES
要满足这些要求,通常需要咨询机构和咨询师的协助。本公司拥有一支经验丰富的咨询师队伍可以为贵司提供这些服务,包括:
协助贵司建立/升级医疗器械质量管理体系,将MDR法规的内容整合进去
协助贵司确定产品的欧盟协调标准,确认检测实验室的,样品准备以及检测不合格整改的研讨
按照MDR要求协助贵司准备技术文件,包括风险分析报告,临床评估资料,基本要求检查表等
协助贵司按照欧盟的要求修订说明书和标签,使其满足出口的要求。
当公告机构现场审核或者文件审核开具不符合时,我们提供整改指导服务,确*整改验证。
-/gbaaeee/-
http://sungoyuan.b2b168.com









