南京MDRCE认证的技术文件怎么做-需要什么材料
更新时间:2025-01-11 浏览数:348
所属行业:
咨询 管理咨询
发货地址:上海市浦东新区陆家嘴街道
产品数量:9999.00个
价格:面议
2016年12月14日,EUDAMED(European databank for medical devices) 筹划指导**上欧盟各国对于医疗器械法规MDR及IVDR的执行进行了一轮的讨论,与会人员对于这两个法规的细节内容进行了讨论并达成了一致意见。在此基础上,会议对于MDR及IVDR的执行达成了如下时间表。
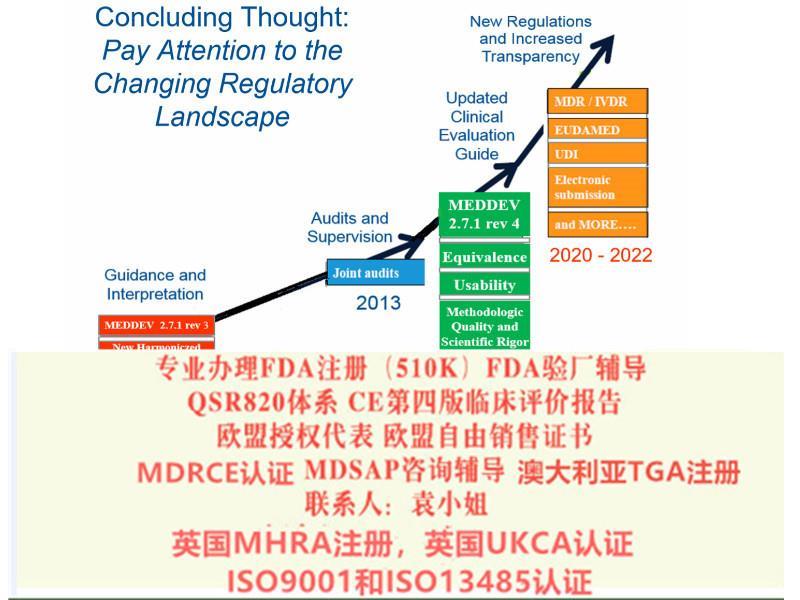
总的说来新的MDR和IVDR加强了体系管理,对高风险设备增加了相关规定比如对于非医疗用途但具有与医疗器械相似特性的设备也将受到新法规的管辖(如用于美容的彩色隐形眼镜),提升了产品对患者的透明度和可追溯性并设立电子数据库(Eudamed)、医疗设备将有一个一的识别号这加强其在整个供应链的可追溯性。

2019 年5 月25 日,MDR 正式生效, 替代了原医疗器械指令(MDD,93/42/EEC)和主动植入式医疗器械指令(AIMD,90/385/EEC)。

MDR实施之后,在三年过渡期内仍然可以按照MDD和AIMDD申请CE证书并保持证书的有效性。依据Article 120 clause2 的规定,过渡期内NB签发的CE证书继续有效,但是从其交付日期起有效期不**过5年,并且于2024年5月27日失效
-/gbaaeee/-
http://sungoyuan.b2b168.com